题目内容
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)?C(g)+D(g),能表明该反应已达到平衡状态的是( )
①混合气体的密度不发生变化时
②容器内气体的压强不发生变化时
③混合气体的总物质的量不发生变化时
④容器内各物质的浓度不随时间变化时
⑤单位时间消耗2mol B同时生成1mol C.
①混合气体的密度不发生变化时
②容器内气体的压强不发生变化时
③混合气体的总物质的量不发生变化时
④容器内各物质的浓度不随时间变化时
⑤单位时间消耗2mol B同时生成1mol C.
| A、①④ | B、②③ |
| C、②③④ | D、只有④ |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:①混合气体的密度不发生变化时,说明气体质量不变,正逆反应速率相等,故正确;
②容器内气体的压强始终不发生变化,故错误
③混合气体的总物质的量始终不发生变化,故错误;
④容器内各物质的浓度不随时间变化时,正逆反应速率相等,故正确;
⑤单位时间消耗2mol B同时生成1mol C,未体现正与逆的关系,故错误;
故选A.
②容器内气体的压强始终不发生变化,故错误
③混合气体的总物质的量始终不发生变化,故错误;
④容器内各物质的浓度不随时间变化时,正逆反应速率相等,故正确;
⑤单位时间消耗2mol B同时生成1mol C,未体现正与逆的关系,故错误;
故选A.
点评:本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
相同条件下,下列关于反应速率的判断正确的是( )
| A、0.1 mol?L-1的盐酸和0.1 mol?L-1的醋酸分别与2mol?L-1的NaOH溶液反应的速率相同 |
| B、0.1 mol?L-1的盐酸和0.1 mol?L-1的硝酸分别与大小相同的大理石反应的速率相同 |
| C、Mg和Fe分别与0.1 mol?L-1的盐酸反应的速率相同 |
| D、大理石块与大理石粉分别与0.1 mol?L-1的盐酸反应的速率相同 |
下列一定能大量共存的离子组是( )
| A、Al3+、Cl-、AlO2-、SO42- |
| B、pH=14的溶液中:Cl-、HCO3-、NO3-、NH4+ |
| C、c(Fe3+)=0.1 mol?L-1的溶液中:Na+、SCN-、Cl-、S2- |
| D、强碱性溶液中:ClO-、SO42-、Na+ |
“富勒烯”家族又增添了新成员,继C60、C70、N60之后,中美科学家首次发现了全硼富勒烯B40.下列说法正确的是( )
| A、B40和C70、都属于新型化合物 |
| B、C60、和N60属于同分异构体 |
| C、B40、C60、N60、C70都只含共价键 |
| D、B40、C60、N60、C70都属于烯烃 |
有关下列四个常用电化学装置的叙述中,正确的是( )
 |  | 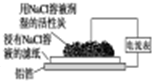 |  |
| 图Ⅰ碱性 锌锰电池 | 图Ⅱ铅硫 酸蓄电池 | 图Ⅲ铝箔的腐蚀 | 图Ⅳ银锌 纽扣电池 |
| A、图Ⅰ所示电池中,MnO2的作用是催化剂,负极反应为:Zn-2e-=Zn2+ |
| B、图Ⅱ所示电池充电过程中,硫酸浓度不断增大,阴极反应为:Pb+SO42-=PbSO4-2e- |
| C、铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-═Cl2↑ |
| D、图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag |
下列能使反应2HCl+2Ag═2AgCl+H2↑的方案是( )
A、 |
B、 |
C、 |
D、 |




