题目内容
(1)不是电解质的物质就是非电解质。 ( )
(2)熔融状态下不导电的化合物是非电解质。 ( )
(3)在化合物中,不是电解质就一定是非电解质。( )
(4)一种物质不可能既不是电解质又不是非电解质。 ( )
(5)难溶于水的物质肯定是非电解质。 ( )
(6)熔融状态下能导电的物质肯定是电解质。 ( )
(2)熔融状态下不导电的化合物是非电解质。 ( )
(3)在化合物中,不是电解质就一定是非电解质。( )
(4)一种物质不可能既不是电解质又不是非电解质。 ( )
(5)难溶于水的物质肯定是非电解质。 ( )
(6)熔融状态下能导电的物质肯定是电解质。 ( )
(1)×
(2)×
(3)√
(4)×
(5)×
(6)×
(2)×
(3)√
(4)×
(5)×
(6)×

练习册系列答案
相关题目

 CO(g)+H2(g)△H=+131.3kJ?mol-1,
CO(g)+H2(g)△H=+131.3kJ?mol-1, 在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.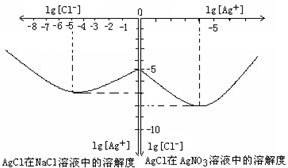
 以下都是我们生活、学习中常见的物质,请按照要求回答相关问题:
以下都是我们生活、学习中常见的物质,请按照要求回答相关问题:
 ,下列说法正确的是
,下列说法正确的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1