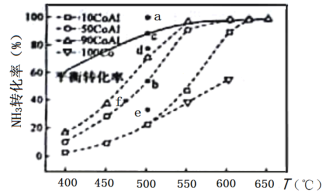
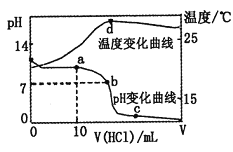
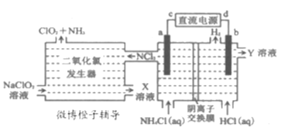
题目内容
【题目】实验室还可以利用高锰酸钾制氯气,其原理为:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O,若有15.8g KMnO4做氧化剂,试计算参加反应盐酸的物质的量和被氧化的盐酸的质量____________。
【答案】0.8mol;18.25g
【解析】
在2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O,中高锰酸钾为氧化剂,浓盐酸为还原剂,根据Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,根据化学方程式计算参加反应的HCl的物质的量和被氧化的盐酸的质量。
15.8gKMnO4的物质的量为![]() =0.1mol,由2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O可知,参加反应的HCl的物质的量为0.1mol×
=0.1mol,由2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O可知,参加反应的HCl的物质的量为0.1mol×![]() =0.8mol,其中被氧化的HCl的质量为0.8mol×
=0.8mol,其中被氧化的HCl的质量为0.8mol×![]() ×36.5g/mol=18.25g。
×36.5g/mol=18.25g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】“地沟油”泛指生活中产生的、不宜继续食用的油脂。地沟油经脱胶、洗涤、脱色等预处理,用来制备脂肪酸钠(RCOONa),在消除危害的同时,还可用于处理含Cu2+的废水。
已知:2RCOO-+Cu2+![]() (RCOO)2Cu
(RCOO)2Cu
(1)可利用活性炭对地沟油进行脱色处理,这利用了活性炭的____________性。
(2)取30 mL三油酸甘油酯在不同条件下水解,实验结果如下表所示。
序号 | 试剂 | 温度 | 时间 | 水解率 |
a | 20 mL3 mol/L H2SO4 | 95℃ | 3小时 | 52.1% |
b | 20 mL 6 mol/LNaOH | 70℃ | 1.5 | 97.7% |
①实验a中,三油酸甘油酯水解的产物是____________(填物质名称)。
②对比实验a、b可以得到的结论有____________(写出2条)。
(3)将预处理后的地沟油水解,用水解所得液体去除Cu2+的实验过程如下图所示。

①RCOONa属于____________(填“离子化合物”或“共价化合物”)。
②实验表明,硫酸酸化后液体的pH会影响Cu2+的去除率。实验测得,pH=5时Cu2+的去除率低于pH=7时的,其原因为____________。