��Ŀ����
��14�֣�ij������Ԫ�ص�ԭ������������Ϊ������2�����䵥�ʼɷ������·�Ӧ��
�� + �� �� + �� + ˮ��
�� + �� + ˮ��
��1������ΪNO2��
�ټ����ҷ�Ӧ�Ļ�ѧ����ʽΪ ��
�ڻ������NO2�Ķ�����N2O4�����������£�N2H4����ȼ�ϣ���֪��
N2(g)��2O2(g)��2NO2(g) ��H ����67.7kJ��mol-1
N2H4(g)��O2(g)��N2(g)��2H2O(g) ��H ����534.0kJ��mol-1
2NO2(g) N2O4(g) ��H ����52.7kJ��mol-1
N2O4(g) ��H ����52.7kJ��mol-1
��д����̬�£�N2H4������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽ��
___________________________________________________��
�����ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�ء���ȼ�ϵ��ԭ������ͼ��ʾ���ұߵ缫Ϊ �������������������������ߵ缫�Ϸ����ĵ缫��ӦʽΪ ��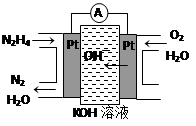
��2������ΪSO2��
�ٰ��ҵ�������ͭ�����У��۲쵽�������� ��
��SO2�����ж��������SO2���峣��������NaOH��Һ���գ�д������Һ������Ũ���ɴ�С��˳�� ��
����������ԭ��Ӧ�Ĺ����У�������Ӧ�ͻ�ԭ��Ӧͬʱ�������йط�Ӧ��
SO2��2e����2H2O = SO42����4H����Ӧ��˵��������� ��
| A���÷�ӦΪ������Ӧ |
| B��������Ӧ����ת�Ƶ������ʵ���Ϊ0.05mol����������Һ��PHֵΪ1 |
| C��Fe2(SO4)3��Ʒ��������Һ����ʹ������Ӧ���� |
| D��ͨ��Cl2�ή��SO2��Ư������ |
��1���� C + 4HNO3��Ũ�� CO2��+ 4NO2��+ 2H2O ��2�֣�
CO2��+ 4NO2��+ 2H2O ��2�֣�
��2N2H4(g)��N2O4(g)��3N2(g)��4H2O(g) ��H����947.6 kJ�� mol��1 ��2�֣�
������ ��2�֣� N2H4��4e����4OH����N2��4H2O ��2�֣�
��2������ɫ������ɫ��ĩ ��2�֣�
�� c(Na+) > c( SO32-) > c(OH-) > c( HSO3-) > c(H+) ��2�֣�
�� B C ��2�֣�
����

 ��+��+ˮ��
��+��+ˮ�� ��
�� ��
�� MnO4- +
MnO4- +  2SO3(g) ��H< 0��Ӧ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= �������ʽ������Ӧ��ƽ��ʱ�����ı�����һ������x�������ͼ�����ߵ��� ������ţ���
2SO3(g) ��H< 0��Ӧ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= �������ʽ������Ӧ��ƽ��ʱ�����ı�����һ������x�������ͼ�����ߵ��� ������ţ���
 �� + �� + ˮ��
�� + �� + ˮ�� N2O4(g)
��H ����52.7kJ��mol-1
N2O4(g)
��H ����52.7kJ��mol-1