题目内容
(1)实验室用二氧化锰跟浓盐酸反应制取氯气的化学方程式为:
MnO2+4HCl
MnCl2+Cl2↑+2H2O的反应中,
①标出化合价,用双线桥表示电子的转移情况 ;
② 是氧化剂, 是氧化产物, 元素被还原;
③写出该反应的离子方程式
④氧化剂与还原剂物质的量之比为 .
(2)根据以下三个反应
①Fe+CuCl2═FeCl2+Cu
②Cl2+2FeCl2═2FeCl3
③Cu+2FeCl3═CuCl2+2FeCl2
将以下四种物质按氧化性由强到弱的顺序排列 (用字母表示)
A.CuCl2 B.FeCl2 C.FeCl3 D.Cl2.
MnO2+4HCl
| ||
①标出化合价,用双线桥表示电子的转移情况
②
③写出该反应的离子方程式
④氧化剂与还原剂物质的量之比为
(2)根据以下三个反应
①Fe+CuCl2═FeCl2+Cu
②Cl2+2FeCl2═2FeCl3
③Cu+2FeCl3═CuCl2+2FeCl2
将以下四种物质按氧化性由强到弱的顺序排列
A.CuCl2 B.FeCl2 C.FeCl3 D.Cl2.
考点:氧化性、还原性强弱的比较,氧化还原反应
专题:氧化还原反应专题
分析:(1)根据MnO2+4HCl
MnCl2+Cl2↑+2H2O,在氧化还原反应中,化合价升高值=化合价降低值=转移电子数;Mn元素化合价降低,MnO2是氧化剂,Cl元素化合价升高,HCl是还原剂;根据反应方程式来书写离子方程式;根据元素的化合价的变化,判断氧化剂和还原剂,结合物质的量的关系从化合价的角度分析;
(2)根据氧化还原反应中含有元素化合价降低的物质为氧化剂,氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性来解答.
| ||
(2)根据氧化还原反应中含有元素化合价降低的物质为氧化剂,氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性来解答.
解答:
解:(1)①在MnO2+4HCl (浓)
MnCl2+Cl2↑+2H2O的反应中,锰元素化合价降低,氯元素化合价升高,转移电子数为2mol,用“双线桥法”表示氧化还原反应中电子转移情况为: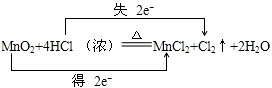 ,
,
故答案为: ;
;
②Mn元素化合价降低,被还原,MnO2是氧化剂,氯元素化合价升高,还原剂是HCl,氧化产物是Cl2,
故答案为:MnO2;Cl2;Mn;
③MnO2+4HCl
MnCl2+Cl2↑+2H2O,反应的实质是二氧化锰在酸性条件下氧化氯离子,其反应离子方程式为:MnO2+4H++2Cl-(浓)
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-(浓)
Mn2++Cl2↑+2H2O;
④氧化剂为MnO2,还原剂为HCl,当有1molMnO2反应时,有2molHCl被氧化,氧化剂与还原剂物质的量之比为1:2,
故答案为:1:2;
(2)①中Cu元素的化合价降低,则CuCl2为氧化剂,氧化性Cu2+>Fe2+,
②中Cl元素的化合价由0降低为-1价,则Cl2为氧化剂,氧化性Cl2>Fe3+,
③中Fe元素的化合价由+3价降低为+2价,则FeCl3为氧化剂,氧化性Fe3+>Cu2+,
则各粒子氧化性由强到弱的顺序为Cl2>Fe3+>Cu2+>Fe2+,所以氧化性由强到弱的顺序排列为:DCAB;
故答案为:DCAB.
| ||
 ,
,故答案为:
 ;
;②Mn元素化合价降低,被还原,MnO2是氧化剂,氯元素化合价升高,还原剂是HCl,氧化产物是Cl2,
故答案为:MnO2;Cl2;Mn;
③MnO2+4HCl
| ||
| ||
故答案为:MnO2+4H++2Cl-(浓)
| ||
④氧化剂为MnO2,还原剂为HCl,当有1molMnO2反应时,有2molHCl被氧化,氧化剂与还原剂物质的量之比为1:2,
故答案为:1:2;
(2)①中Cu元素的化合价降低,则CuCl2为氧化剂,氧化性Cu2+>Fe2+,
②中Cl元素的化合价由0降低为-1价,则Cl2为氧化剂,氧化性Cl2>Fe3+,
③中Fe元素的化合价由+3价降低为+2价,则FeCl3为氧化剂,氧化性Fe3+>Cu2+,
则各粒子氧化性由强到弱的顺序为Cl2>Fe3+>Cu2+>Fe2+,所以氧化性由强到弱的顺序排列为:DCAB;
故答案为:DCAB.
点评:本题考查学生离子反应和氧化还原反应的概念,注意氧化性强弱的判断的方法,难度不大.

练习册系列答案
相关题目
工业生产金刚砂(SiC中Si为+4价,C为-4价)的化学方程式为SiO2+3C═SiC+2CO↑在这个反应中,氧化剂和还原剂的质量比( )
| A、2:1 | B、1:2 |
| C、5:3 | D、3:5 |
某SO2与SO3的混合气体,平均摩尔质量为70g/mol.则该气体中SO2与SO3分子数之比为( )
| A、3:5 | B、5:3 |
| C、7:5 | D、5:7 |
某原电池的电池反应为Fe+2Fe3+═3Fe2+,与此电池反应相符的原电池是( )
| A、铜片、铁片、FeCl2溶液组成的原电池 |
| B、石墨、铁片、Fe(NO3)3溶液组成的原电池 |
| C、铁片、锌片、Fe2(SO4)3溶液组成的原电池 |
| D、银片、石墨、Fe(NO3)2溶液组成的原电池 |
下列物质中,与标况下22.4L O3具有相同O原子数的是( )
| A、含有3mol MgO |
| B、88g CO2气体 |
| C、标况下22.4L H2O |
| D、标况下22.4L SO2气体 |
常温下,下列说法正确的是( )
| A、相同浓度和体积的强酸与强碱溶液混合,溶液的pH一定等于7 |
| B、在AgCl的悬浊液中加入少量NaCl固体,c(Ag+)减小,AgCl固体质量增大 |
| C、明矾可用于水的杀菌﹑消毒 |
| D、将pH相等的醋酸钠和碳酸钠溶液稀释相同倍数,前者的pH较大 |
室温下,下列各组离子在指定溶液中能大量共存的是( )
| A、含有大量NO3-的水溶液中:Na+、Fe2+、SO42-、H+ |
| B、在pH=12的溶液中:ClO-、S2-、Na+、K+ |
| C、能使pH试纸变蓝的溶液:NH4+、Na+、SO42-、Fe3+ |
| D、含有大量HCO3-的澄清透明溶液中:K+、C6H5O-、Cl-、CH3COO- |
下列离子方程式正确的是( )
| A、NH4HCO3于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| B、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D、向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |