题目内容
现有一包固体粉末,其中可能含有CaCO3 Na2CO3 Na2SO4 NaCi CuSO4.进行如下实验:(1)溶于水得无色溶液;(2)向溶液中加BaCI2溶液生成白色沉淀,再加盐酸时沉淀消失.据上述实验现象推断:
(1)一定不存在的物质是 .
(2)一定存在的物质是 .
(3)可能存在的物质是 .
(1)一定不存在的物质是
(2)一定存在的物质是
(3)可能存在的物质是
考点:几组未知物的检验
专题:物质检验鉴别题
分析:混合固体加入水中,得到无色溶液,则有色离子不存在,难溶物不存在;若得到沉淀,可能是新生成的沉淀,也可能是本来混合物中就有不溶于水的物质.所以在分析时要注意各种可能的存在;混合物溶于水得到无色溶液可以排除CaCO3、CuSO4的存在;加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失,说明不存在Na2SO4,白色沉淀应是碳酸钠反应生成的碳酸钙白色沉淀,一定存在碳酸钠,氯化钠无法确定,据此回答判断.
解答:
解:①根据固体加入水中,得到无色溶液.说明混合物中不含有颜色的CuSO4,同时由于不存在沉淀,则原混合物中不含有不溶于水的CaCO3;
②向溶液中加BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失,说明原混合物中一定不含Na2SO4,因为硫酸钡不溶于酸;能生成白色沉淀的物质只能是Na2CO3;
综上所述,原混合物中一定含有Na2CO3,一定不存在CaCO3、CuSO4、Na2SO4,NaCl无法确定;
(1)一定不存在CaCO3、CuSO4、Na2SO4,故答案为:CaCO3、CuSO4、Na2SO4;
(2)一定存在的物质是Na2CO3,故答案为:Na2CO3;
(3)可能存在的物质是NaCl,故答案为:NaCl.
②向溶液中加BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失,说明原混合物中一定不含Na2SO4,因为硫酸钡不溶于酸;能生成白色沉淀的物质只能是Na2CO3;
综上所述,原混合物中一定含有Na2CO3,一定不存在CaCO3、CuSO4、Na2SO4,NaCl无法确定;
(1)一定不存在CaCO3、CuSO4、Na2SO4,故答案为:CaCO3、CuSO4、Na2SO4;
(2)一定存在的物质是Na2CO3,故答案为:Na2CO3;
(3)可能存在的物质是NaCl,故答案为:NaCl.
点评:本题属于实验探究题,难度较大,解此类试题时要熟记常见物质的特殊反应现象,如鉴别硫酸根离子用钡离子、鉴别氯离子用银离子、碳酸根与酸反应产生气体等.

练习册系列答案
相关题目
分类是科学研究的重要方法,讨论辨析以下说法:上述说法正确的是( )
①漂白粉、铝热剂、粗盐都是混合物;
②金属氧化物都是碱性氧化物;
③胆矾和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋既是化合物又是酸;
⑥乙醇、四氯化碳、氯气、葡萄糖都是非电解质;
⑦豆浆和雾都是胶体.
①漂白粉、铝热剂、粗盐都是混合物;
②金属氧化物都是碱性氧化物;
③胆矾和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋既是化合物又是酸;
⑥乙醇、四氯化碳、氯气、葡萄糖都是非电解质;
⑦豆浆和雾都是胶体.
| A、①②③④ | B、①③④⑦ |
| C、①②⑤⑥ | D、③⑤⑥⑦ |
合乎实际并用于工业生产的是( )
| A、Na在Cl2中燃烧制NaCl |
| B、氯气溶于水制盐酸 |
| C、Cl2与石灰乳作用制漂白粉 |
| D、H2和Cl2混合光照制HCl |
联合制碱法中的副产品有着多种用途,下列不属于其用途的是( )
| A、做电解液 | B、制焊药 |
| C、做化肥 | D、合成橡胶 |
下列关于某些离子的检验说法中正确的是( )
| A、向某溶液中加入氯化钡溶液,产生白色沉淀,过滤后向溶液中加入硝酸银溶液,有白色沉淀生成,则原溶液中一定有Cl-和SO42- |
| B、向某溶液中加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- |
| C、向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中不一定含有Cl- |
| D、向某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液中一定有Ca2+ |
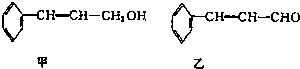
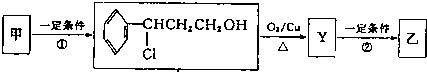
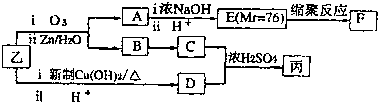
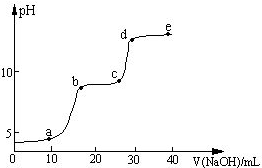 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.