题目内容
将1L 0.1mol?L-1 BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1L 0.5mol?L-1 HCl溶液与足量CH3COONa溶液充分反应放出b kJ热量(不考虑醋酸钠水解);将0.5L 1mol?L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为( )
| A、(5a-2b) kJ |
| B、(4b-10a) kJ |
| C、(5a+2b) kJ |
| D、(10a+4b) kJ |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:将0.5L 1mol?L-1 H2SO4溶液与足量(CH3COO)2Ba溶液反应,涉及的离子方程式有Ba2+(aq)+SO42-(aq)=BaSO4(s),H+(aq)+CH3COO(aq)=CH3COOH(l),
将1L 0.1mol?L-1 BaCl2溶液与足量稀硫酸反应,涉及的离子方程式为:Ba2+(aq)+SO42-(aq)=BaSO4(s),
将1L 0.5mol?L-1 HCl溶液与足量CH3COONa溶液反应,涉及的离子方程式为H+(aq)+CH3COO(aq)=CH3COOH(l),从能量守恒的角度解答.
将1L 0.1mol?L-1 BaCl2溶液与足量稀硫酸反应,涉及的离子方程式为:Ba2+(aq)+SO42-(aq)=BaSO4(s),
将1L 0.5mol?L-1 HCl溶液与足量CH3COONa溶液反应,涉及的离子方程式为H+(aq)+CH3COO(aq)=CH3COOH(l),从能量守恒的角度解答.
解答:
解:1L 0.1mol?L-1 BaCl2的物质的量为0.1mol,将1L 0.1mol?L-1 BaCl2溶液与足量稀硫酸反应,涉及的离子方程式为:Ba2+(aq)+SO42-(aq)=BaSO4(s),放出akJ热量,生成0.1molBaSO4,则生成0.5molBaSO4,放出5akJ热量,
1L 0.5mol?L-1 HCl溶液的物质的量为0.5mol,将1L 0.5mol?L-1 HCl溶液与足量CH3COONa溶液反应,涉及的离子方程式为H+(aq)+CH3COO-(aq)=CH3COOH(l),放出b kJ热量,生成0.5molCH3COOH,则生成1molCH3COOH,放出2bkJ热量,
所以0.5L 1mol?L-1 H2SO4的物质的量为0.5mol,将0.5L 1mol?L-1 H2SO4溶液与足量(CH3COO)2Ba溶液反应,生成0.5molBaSO4,1molCH3COOH,涉及的离子方程式有Ba2+(aq)+SO42-(aq)=BaSO4(s),H+(aq)+CH3COO-(aq)=CH3COOH(l),溶液反应放出的热量为(5a+2b)kJ,
故选C.
1L 0.5mol?L-1 HCl溶液的物质的量为0.5mol,将1L 0.5mol?L-1 HCl溶液与足量CH3COONa溶液反应,涉及的离子方程式为H+(aq)+CH3COO-(aq)=CH3COOH(l),放出b kJ热量,生成0.5molCH3COOH,则生成1molCH3COOH,放出2bkJ热量,
所以0.5L 1mol?L-1 H2SO4的物质的量为0.5mol,将0.5L 1mol?L-1 H2SO4溶液与足量(CH3COO)2Ba溶液反应,生成0.5molBaSO4,1molCH3COOH,涉及的离子方程式有Ba2+(aq)+SO42-(aq)=BaSO4(s),H+(aq)+CH3COO-(aq)=CH3COOH(l),溶液反应放出的热量为(5a+2b)kJ,
故选C.
点评:本题考查热化学方程式的书写和反应热的计算,注意从能量守恒的角度解答该题,题目难度中等.

练习册系列答案
相关题目
下列各组中的两种物质,不是同系物的是( )
| A、硬脂酸甘油酯和三乙酸甘油酯 |
| B、油酸和丙烯酸 |
| C、乙二醇和丙三醇 |
| D、甲烷和异丁烷 |
对于2A2+3B2?C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A、v(B2)=0.6mol/(L?s) |
| B、v(A2)=0.5mol/(L?s) |
| C、v(C)=0.45mol/(L?s) |
| D、v(B2)=2.4mol/(L?min). |
在铁的吸氧腐蚀中,发生还原反应的那个电极上进行的电极反应是( )
| A、O2+2H2O+4e-=4OH- |
| B、2H++2e=H2↑ |
| C、4 OH-=2H2O+O2+4e- |
| D、Fe=Fe2++2e- |
已知元素的原子序数,不可以推知原子的下列情况有( )
| A、中子数 |
| B、核电荷数 |
| C、核外电子数 |
| D、在周期表中的位置 |
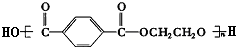
 )是食品添加剂的增香原料,其合成路线如图:
)是食品添加剂的增香原料,其合成路线如图:


 ,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式
,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式