题目内容
19.下列单质熔、沸点随原子序数递增而升高的是B(填序号).A.碱金属元素 B.卤族元素.
分析 碱金属,金属晶体熔点看金属键的强弱.金属离子半径小,所带电荷多,金属键强,熔点就越高;卤素,分子晶体看分子间作用力的强弱.对组成和结构相似的物质,相对分子质量大,分子间作用力强,熔点就越高,由此分析解答.
解答 解:卤素都是分子晶体,氟气的相对分子量最小,而碘单质的相对分子量最大,所以卤素单质的熔、沸点随原子序数递增而升高,故答案为:B;
点评 本题考查单质的物理性质的判断、元素周期律的相关知识和卤素的性质,但比较容易,学生要清楚不同类型晶体的熔沸的影响因素.

练习册系列答案
相关题目
17.下列属于高分子化合物且在自然界中原来并不存在的是( )
| A. | 淀粉 | B. | 蛋白质 | C. | 纤维素 | D. | 聚乙烯 |
14.下列说法合理的是( )
| A. | 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | 邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键 | |
| D. | 若X+和Y2-的核外电子层结构相同,则原子序数:Y<X |
8.下列溶液中,溶质的物质的量浓度为0.1mol/L的是( )
| A. | 1L溶液中含有4g NaOH | B. | 1L水中溶解4gNaOH | ||
| C. | 0.5L溶液中含有0.2mol H2SO4 | D. | 9.8g H2SO4溶于1L水配成溶液 |
 (足量)
(足量) +4H2$\stackrel{催化剂}{→}$
+4H2$\stackrel{催化剂}{→}$ .
.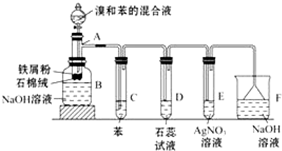 图为苯和溴的取代反应的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉.
图为苯和溴的取代反应的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉. .
.