题目内容
16.等质量的SO2和SO3含有的氧原子个数比为5:6;含有2.3g Na的Na2R的物质的量为0.05mol.分析 结合n=$\frac{m}{M}$、N=nNA及分子构成计算.
解答 解:等质量的SO2和SO3含有的氧原子个数比为$\frac{m}{64}$×2:$\frac{m}{80}$×3=5:6;含有2.3g Na,钠的物质的量为$\frac{2.3g}{23g/mol}$=0.1mol,可知Na2R的物质的量为$\frac{0.1mol}{2}$=0.05mol,
故答案为:5:6;0.05 mol.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成,题目难度不大.

练习册系列答案
相关题目
11.如图是温度和压强对 X+Y?2Z反应影响示意图,下列叙述正确是( )
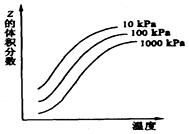

| A. | 正反应为放热 | |
| B. | 其他条件不变,升高温度,X和Y的转化率均降低 | |
| C. | X、Y、Z均为气态 | |
| D. | Z为气态,X和Y只有一种气态 |
4.在密闭容器中,将一定量A、B气体混合后发生反应:xA(g)+yB(g)?zC(g)+mD(s).平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.3mol/L.则下列有关判断正确的是( )
| A. | x+y>z+m | B. | B的转化率一定减小 | ||
| C. | 平衡向正反应方向移动 | D. | 混合气体的密度一定减小 |
11.下列叙述正确的是( )
| A. | 1mol任何气体的体积都是22.4L | |
| B. | 在非标准状况下,1mol任何气体的体积不可能是22.4L | |
| C. | 在标准状况下,NA个混合气体分子的体积约为22.4L | |
| D. | 同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同 |
1.下列离子方程式正确的是( )
| A. | 硫氰化钾溶液与氯化铁溶液反应:3SCN-+Fe3+?Fe(SCN)3↓ | |
| B. | 氧气通入稀硫酸酸化的KI溶液:O2+2 H2O+4I-═2I2+4OH- | |
| C. | 酸性高锰酸钾溶液与草酸溶液反应:2MnO4-+5C2O42-+16H+═2Mn2++8H2O+10CO2↑ | |
| D. | 向盐酸中逐滴加入等体积等浓度的碳酸钠溶液:CO32-+2H+═CO2↑+H2O |
8.下列叙述正确的是( )
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | 同一周期元素的最高化合价从左到右从+1递增到+7 | |
| C. | IA族与ⅦA族元素间形成的化合物,有共价化合物也有离子化合物 | |
| D. | 非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构 |
5.表中物质的分类组合完全正确的是( )
| 编 号 | A | B | C | D |
| 强电解质 | KNO3 | H2SO4 | BaSO4 | HClO4 |
| 弱电解质 | CH3COONH4 | CaCO3 | H2CO3 | NH3•H2O |
| 非电解质 | SO2 | CS2 | H2O | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
6.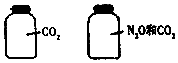 如图所示.两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不反应)关系一定不正确的是( )
如图所示.两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不反应)关系一定不正确的是( )
 如图所示.两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不反应)关系一定不正确的是( )
如图所示.两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不反应)关系一定不正确的是( )| A. | 所含氧原子数相等 | B. | 气体的总质量相等 | ||
| C. | 气体的平均摩尔质量相等 | D. | 气体的密度相等 |