题目内容
13. 利用如图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物).
利用如图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物).请填写下列空白:
(1)检验乙醛的试剂是ac;(选填编号)
a.银氨溶液 b.碳酸氢钠溶液 c.新制氢氧化铜 d.氧化铜
乙醇发生催化氧化的化学反应方程式为2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;
(2)实验开始时,是先鼓入空气还是先点燃酒精灯加热铜丝?先点燃酒精灯加热铜丝,原因是先产生氧化铜使乙醇反应更充分;该实验中“鼓气速度”这一变量你认为可用单位时间内甲中的气泡量来估量;
(3)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是使生成乙醇蒸气的速率加快且较均匀.以下实验需要水浴加热的是bd;(选填编号)
a.卤代烃水解 b.银镜反应 c.乙酸丁酯 d.苯的硝化反应
(4)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色(假设两者恰好完全反应).该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应.请你设计一个简单的实验,探究哪一种猜想正确?用pH试纸检测溴水与褪色后溶液的酸碱性.若酸性明显增强,则猜想①正确;反之,猜想②正确.
分析 (1)含有醛基的物质能够发生银镜反应,能够与新制的氢氧化铜反应;
乙醇催化氧化生成乙醛和水;
(2)铜与氧气反应生成氧化铜,氧化铜与乙醇反应生成乙醛,先点燃酒精灯加热铜丝生成氧化铜,能够使乙醇更充分的反应;该实验中“鼓气速度”这一变量你认为可用单位时间内甲中的气泡量来估测;
(3)水浴加热可以让乙醇在一定的温度下成为蒸气,从而加快反应的速率;依据反应条件判断解答;
(4)若是乙醛被氧化,则有乙酸和溴化氢生成,溶液呈强酸性;若是发生加成反应,则生成饱和含溴有机物,溶液仍为中性,故可利用酸碱指示剂来确定哪种猜想是正确的;
解答 解:(1)乙醛含有醛基,能够发生银镜反应,与新制的氢氧化铜反应生成砖红色沉淀,所以通常用银氨溶液、新制的氢氧化铜检验;
乙醇催化氧化生成乙醛和水,化学方程式:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;
故答案为:ac;2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;
(2)铜与氧气反应生成氧化铜,氧化铜与乙醇反应生成乙醛,先点燃酒精灯加热铜丝生成氧化铜,能够使乙醇更充分的反应;该实验中“鼓气速度”这一变量你认为可用单位时间内甲中的气泡量来估测;
故答案为:先点燃酒精灯加热铜丝;先产生氧化铜使乙醇反应更充分;单位时间内甲中的气泡量.
(3)将甲装置浸在70℃~80℃的水浴中,使生成乙醇蒸气的速率加快且较均匀;水浴加热温度为小于100度,
a.卤代烃水解反应条件为加热,不需要水浴加热,故不选;
b.银镜反应需要的温度不超过100℃,故可以用水浴加热,故b选;
c.制取乙酸乙酯需要的温度较高,需要用酒精灯直接加热,不能用水浴加热,故C不选;
d.苯和浓硝酸、浓硫酸在50℃~60℃发生硝化反应生成硝基苯和水,应用水浴加热,故d选;
故选:bd;
(4)乙醛具有还原性,乙醛被溴水氧化生成乙酸和HBr,溶液呈酸性,乙醛分子中含有不饱和键,溴水可能与乙醛发生加成反应,没有HBr生成,溶液不呈酸性,所以检验褪色后溶液的酸碱性,确定其发生哪类反应,
故答案为:用pH试纸检测溴水与褪色后溶液的酸碱性.若酸性明显增强,则猜想①正确,反之猜想②正确.
点评 本题考查了乙醇的催化氧化,掌握乙醇的组成、结构及具有的化学性质,明确乙醇催化氧化的原理是解题关键,题目难度中等.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(2)要计算出盐酸的物质的量浓度,题中可作为计算依据的数据是乙或丙,求得盐酸的物质的量浓度为1mol/L.
(3)求合金中镁、铝的物质的量之比,题中可作为计算依据的数据是甲,求得的镁、铝的物质的量之比是1:1.
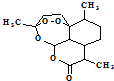 ,有关叙述正确的是d(选填序号).
,有关叙述正确的是d(选填序号).a.化学式为C15H21O5 b.不能与NaOH溶液反应
c.易溶于水 d.含有过氧键,有较强氧化性
由青蒿酸为原料出发,经五步合成可得到青蒿素.其中第2步为还原反应:
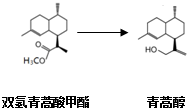
常温下即可反应且略放热,还原剂为LiAlH4.相关物质的性质:
| 物质 | 性质 |
| 双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂. |
| 青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂. |
| 乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点:34.6℃. |
| 氢化铝锂 | 固体,溶于乙醚. 与水反应:LiAlH4+4H2O→Al(OH)3↓+LiOH+4H2↑ 可将一分子酯还原成二分子醇,自身生成醇铝、醇锂. (醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇). |
(1)反应中使用过量的氢化铝锂,理由是提高双氢青蒿酸甲酯的转化率.
为使反应在溶液状态下进行,可用乙醚为溶剂,不用水的理由是双氢青蒿酸甲酯不溶于水,氢化铝锂会与水反应.
(2)请设计实验室制备装置(画出草图):

(3)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂.从反应混合物中提取青蒿醇的方法是:
①加盐酸后分液;
②从乙醚层提取青蒿醇.有多种方法,以下是二种方案:
方案一:蒸发结晶. 方案二:蒸馏析出晶体.
a.这2个方案在析出晶体后都应有残留液,原因是防止氢青蒿酸甲酯析出.
b.请对这2个方案进行比较方案二可回收乙醚、甲醇.
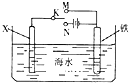
| A. | 若X为碳棒,开关K置于N处,可以加快铁的腐蚀 | |
| B. | 若X为碳棒,开关K置于N处,则X极附近溶液变黄色 | |
| C. | 若X为锌,开关K置于M处,保护铁电极则为牺牲阳极的阴极保护法 | |
| D. | 若X为锌,开关K置于M处,则X电极的反应式为:O2+4e+2H2O→4OH- |
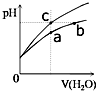 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、b、c三点溶液的离子浓度之和a>b>c | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,恰好反应时消耗NaOH溶液的体积Vb=Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
| A. | 16O和18O在自然界的含量保持不变 | |
| B. | 16O和18O的质量数不同,质子数相同 | |
| C. | 16O和18O可以通过化学反应相互转化 | |
| D. | 16O和18O核外电子数相同,化学性质几乎相同 |
| A. | 若晶体熔融状态下能导电,该晶体一定是离子晶体 | |
| B. | 若晶体熔化时化学键断裂,该晶体一定是原子晶体 | |
| C. | 若晶体中含有非极性分子,该晶体可能有较低的熔沸点 | |
| D. | 若晶体中含有极性共价键,该晶体不可能有很高的熔沸点 |
| A. | x=20 | B. | x=40 | C. | 20<x<40 | D. | x>40 |
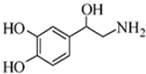
| A. | 该有机物的分子式是C8H10NO3 | |
| B. | 1mol该有机物最多能与2molBr2发生反应 | |
| C. | 该有机物不能与Na2CO3溶液反应 | |
| D. | 该有机物既能与盐酸反应,又能与氢氧化钠溶液反应 |