题目内容
【题目】工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如下:
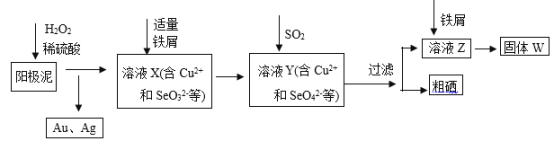
(1)向溶液X中加入铁屑的作用是______ ,此操作中不能加入过量铁粉的原因是______。
(2)检验溶液Z中阴离子的操作方法是______。
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:______。
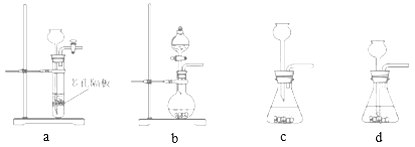
(4)实验室中制取SO2的原理为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。
(5)粗硒中硒的含量可用如下方法测定:
①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
②SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O
③I2+2Na2S2O3=Na2S4O6+2NaI
通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol/L的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为_______ 。
【答案】将SeO42-还原为SeO32- 过量铁粉会将Cu2+、SeO32-均还原为单质,不利于硒的分离 取溶液X少许置于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42- 粗盐提纯、一定物质的量浓度溶液的配制、物质的溶解、溶液的蒸发、浓硫酸的稀释等 较浓的硫酸 SO2易溶于水,用较浓的硫酸有利于SO2的逸出 b 锥形瓶、碱式滴定管 90.85%
【解析】
(1)根据流程图中加入铁屑前后溶液中的离子种类的变化确定加入铁粉的作用,结合铁粉还原性分析加入量的多少的影响;
(2)根据流程图可知前面加入了SO2,则溶液中含有SO42-,根据检验SO42-的方法分析;
(3)根据玻璃棒在实验中的作用分析;
(4)SO2在水中的溶解度较大,在浓硫酸中溶解度较小;根据反应的特点选择装置;
(5)Na2S2O3标准溶液显碱性应用碱式滴定管盛放,待测溶液用锥形瓶盛放;根据反应的方程式可知,SeO2~2I2~4Na2S2O3,根据n=c·V计算消耗的n(Na2S2O3),根据关系式计算样品中n(SeO2),再根据m=n·M计算Se的质量,进而计算样品中Se的质量分数。
(1)根据流程图可知:加入铁屑后溶液中的SeO42-被还原为SeO32-,所以向溶液X中加入铁屑的作用是:将SeO42-还原为SeO32-;铁粉具有较强的还原性,能还原Cu2+、SeO32-,所以加过量铁粉会将Cu2+、SeO32-均还原为单质,不利于硒的分离;
(2)根据流程图可知前面加入SO2,则溶液中有SO42-,检验SO42-的方法为:取溶液X少许置于试管中,滴加盐酸酸化,然后再加入BaCl2溶液,若有白色沉淀生成,说明溶液中含有SO42-;
(3)实验操作中常常用到玻璃棒,溶解时用玻璃杯搅拌,过滤时用玻璃棒引流,溶液蒸发用玻璃棒搅拌等;
(4)SO2在水中的溶解度较大,在浓硫酸中溶解度较小,用较浓的硫酸有利于SO2的逸出,所以选用较浓的硫酸与亚硫酸钠反应;根据实验室中制取SO2的原理为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,可知该反应为固体粉末与液体的反应,反应不需要加热,使用分液漏斗加硫酸容易控制加入硫酸的量,所以最好选用如图2中的b;
(5)Na2S2O3是强碱弱酸盐,在溶液中水解使溶液显碱性,所以Na2S2O3标准溶液应用碱式滴定管盛放,待测溶液用锥形瓶盛放,则滴定操作中用到的玻璃仪器有锥形瓶、碱式滴定管;
根据已知反应的方程式可得关系式:SeO2~2I2~4Na2S2O3,反应消耗Na2S2O3的物质的量n(Na2S2O3)=0.2000mol/L×0.0276L=0.00552mol,则样品中SeO2的物质的量n(SeO2)=![]() ×0.00552mol=0.00138mol,所以Se的质量为0.00138mol×79g/mol=0.10902g,样品中Se的质量分数为
×0.00552mol=0.00138mol,所以Se的质量为0.00138mol×79g/mol=0.10902g,样品中Se的质量分数为![]() ×100%=90.85%。
×100%=90.85%。

【题目】甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护。请回答下列问题:
(1)用甲烷催化还原氮的氧化物可消除氮氧化物的污染。已知:

反应过程(2)是__反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是__。
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
实验 序号 | 温度℃ | 初始n(CCl4)( mol) | 初始n(H2)( mol) | 平衡时n(CHCl3)( mol) |
1 | 110 | 0.8 | 1.2 | |
2 | 110 | 2 | 2 | 1 |
3 | 100 | 1 | 1 | 0.6 |
①此反应在110℃时平衡常数为___。
②实验l中,CCl4的转化率为__。
③判断该反应的正反应是__(填“放热”或“吸热”),理由是__。
④为提高实验3中CCl4的转化率,可采取的措施是__。
a.使用高效催化剂
b.向容器中再投入1molCCl4和1molH2
c.温度升高到200℃
d.向容器中再投入1molHCl
e.向容器中再投入1molH2