题目内容
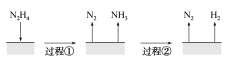
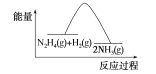
【题目】A、B、C、D 均是短周期元素,A 和 B 同周期, B 和 C 同族,A 元素族序数是周期数的三倍,B 原子最外层电子数是内层电子数的二倍,B 与 A 能生成化合物 BA2,C 与 A 生 成化合物 CA2, A 的阴离子与 D 的阳离子电子层结构相同,都与氖原子的电子层结构相同, D 的单质与 A 的单质在不同条件下反应,可生成 D2A 或 D2A2。请回答
(1)写出元素符号 B:_____C:_____
(2)D2A2 的化学式_____.
(3)BA2 的电子式_____,BA2 分子中化学键属于_____键。
(4)C 在元素周期表中的位置是第_____周期_____族,其原子结构示意图为______
【答案】C Si Na2O2 ![]() 共价 三 ⅣA
共价 三 ⅣA 
【解析】
A、B、C、D均是短周期元素,A元素族序数是周期数的三倍,A只能处于第二周期,族序数为Ⅵ,故A为O元素;A和B同周期,B原子最外层电子数是内层电子数的二倍,最外层电子数为4,则B为C元素;B和C同族,则C为Si;A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D的单质与A的单质在不同条件下反应,可生成D2A或D2A2,则D为Na元素,据此分析解答。
(1)根据上述分析,A为O元素,B为C元素,C为Si元素,D为Na元素,故答案为:C;Si;
(2)D为Na元素,A为O元素,D2A2的化学式为Na2O2,故答案为:Na2O2;
(3)CO2分子中碳原子与氧原子之间形成2对共用电子对,电子式为![]() ,CO2属于共价化合物,含有共价键,故答案为:
,CO2属于共价化合物,含有共价键,故答案为:![]() ;共价;
;共价;
(4)C为Si元素,在元素周期表中位于第三周期ⅣA族,其原子结构示意图为 ,故答案为:三;ⅣA;
,故答案为:三;ⅣA; 。
。

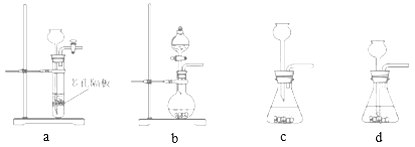
【题目】根据实验室制定硫酸铜结晶水含量的实验,填写下列空白:
实验步骤为:①研磨;②准确称取2.0g已经研碎的硫酸铜晶体;③加热;④冷却;⑤称量;⑥重复③至⑤的操作,直至………;⑦根据实验数据计算硫酸铜晶体里结晶水的含量。请回答相关问题:
(1)步骤①需要的实验仪器是____________,步骤④需要使用的仪器是____________,使用此仪器的目的是防止无水硫酸铜在冷却过程中吸收空气中的水蒸气。
(2)步骤③所用的大部分仪器如下图,在空格中填入仪器的名称:
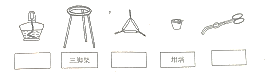
步骤⑥操作位重复③至⑤的操作,直至_______________________________________
(3)某学生实验后得到以下数据:
加热前质量 | 加热后质量 | |
m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
5.400 | 7.900 | 6.800 |
计算:试验测定1mol硫酸铜晶体的结晶水:x=_________________________________,
本次实验的相对误差为______________________。(保留2位小数)
(4)若操作正确,但实验测得的硫酸铜晶体里结晶水的含量偏低。其原因可能是__________(填编号)
A被测样品中含有加热不挥发的杂质 B被测样品中含有加热易挥发的杂质
C实验前被测样品已有部分失水 D加热前所用的坩埚未完全干燥
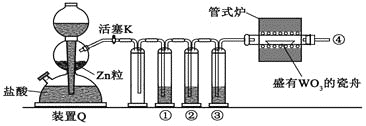
(5)用重量法测定绿矾(FeSO4xH2O)中结晶水含量,加热失水时必须不断通入氮气,装置如图,
说明反应必须在氮气环境中的原因:
_________________________________________________________________________。