题目内容
7.下列有关金属的工业制法中,正确的是( )| A. | 以海水为原料制得精盐,再电解精盐的水溶液制取钠 | |
| B. | 用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁 | |
| C. | 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的CO在高温下还原铁矿石制得铁 | |
| D. | 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝 |
分析 A.工业制钠是电解熔融NaCl来制取,电解纯净的NaCl溶液得到的是氢氧化钠和氢气和氯气;
B.海水中含氯化镁,可用于工业制镁,工业制镁是电解熔融氯化镁来制取;
C.工业上常用用CO在高温下还原铁矿石炼铁;
D.AlCl3为共价键化合物,熔融AlCl3中没有离子,不能导电,工业制铝电解熔融的氧化铝来获取金属铝;
解答 解:A.工业制钠是电解熔融NaCl:2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑,而电解纯净的NaCl溶液:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,得不到钠,故A错误;
B.镁和热水反应生成氢氧化镁和氢气,不能用氢气还原氧化镁制取镁,工业制镁是电解熔融氯化镁:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,故B错误;
C.工业上常用用CO在高温下还原铁矿石炼铁:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,制得铁,故C正确;
D.因为氯化铝是分子晶体,熔融状态下氯化铝不导电,制铝:从铝土矿中获得氧化铝再电解熔融的氧化铝来获取金属铝,故D错误;
故选C.
点评 本题主要考查了有关金属的工业制法,掌握钠、铁、镁、铝及其化合物的性质是解答的关键,题目难度不大.注意氯化铝中没有自由移动的离子,是分子晶体.

练习册系列答案
相关题目
17.伦敦奥运火炬彩用的是环保型燃料--丙烷,其燃烧时发生反应的化学方程式为C3H8+5O2$\frac{\underline{\;点燃\;}}{\;}$3CO2+4H2O.下列说法中不正确的是( )
| A. | 火炬燃烧时化学能只转化为热能 | |
| B. | 所有的燃烧反应都会释放热量 | |
| C. | 1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量 | |
| D. | 丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料 |
15.下列说法正确的是( )
| A. | NaCl与浓H2SO4加热可制HCl,推测NaI与浓H2SO4加热可制HI | |
| B. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 | |
| C. | FeCl3能腐蚀Cu刻制印刷电路板,是因为铁比铜金属性强 | |
| D. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 |
12.下列各组物质中,互为同分异构体的是( )
| A. | 淀粉和纤维素 | B. | 甲烷和乙烷 | C. | 蔗糖和麦芽糖 | D. | 12C和14C |
16.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 含有NA个氖原子的氖气在标准状况下的体积约为11.2 L | |
| B. | 30 g乙烷中含共用电子对总数为8NA | |
| C. | 常温常压下,11.2 L氮气所含的原子数目为NA | |
| D. | 常温下,0.05 mol CO2和SO2混合气体中所含氧原子数为0.1NA |
17.有机物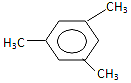 用系统命名法命名的名称为( )
用系统命名法命名的名称为( )
 用系统命名法命名的名称为( )
用系统命名法命名的名称为( )| A. | 间三甲苯 | B. | 1,3,5-三甲苯 | C. | 三甲苯 | D. | 1-3-5,三甲苯 |

 .
.