题目内容
在西部大开发中,将投巨资兴建“西气东输”工程,将西部蕴藏的丰富资源通过管道输送到东部地区。这里所指的“西气”的主要成分是
| A.CH4 | B.CO | C.H2 | D.NH3 |
A
解析试题分析:西气东输中的西气指的是天然气,即甲烷气体,A正确。
考点:考查化石燃料。

(14分)某实验小组用0.50mol/L氢氧化钠溶液和0.50mol/L硫酸溶液进行反应热的测定。
Ⅰ.配制0.50mol/L氢氧化钠溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体_________克。
(2)配制过程中,所需要的玻璃仪器有_____________________________________
Ⅱ.测定稀硫酸和稀氢氧化钠溶液反应的反应热实验装置如下: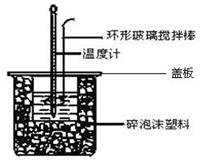
(3)如图装置中仪器环形玻璃搅拌棒作用是___________________________________;
(4)烧杯间填满碎泡沫塑料、大烧杯上加盖硬纸板的作用是__________________
(5)已知稀硫酸与稀氢氧化钠溶液发生中和反应生成1 mol水时,放出57.3 KJ热量。请写出硫酸与氢氧化钠发生中和反应的热化学方程式:__________________________________________,用0.2 mol 稀硫酸溶液与足量稀氢氧化钠溶液反应,能放出________kJ热量。
(6)在测定中和反应的反应热的实验中,下列叙述正确的是
| A.测定中和反应的反应热时,酸碱中和之后应读取体系达到的最高温度 |
| B.中和反应的试验中,应快速将NaOH溶液一次倒入盛盐酸的小烧杯中 |
| C.可以用氢氧化钾代替氢氧化钠,浓硫酸代替稀硫酸 |
| D.在测定中和反应的反应热实验中,每完成一次反应热热测定,至少需要读三次温度 |
下列盐的水溶液,其pH值小于7的是( )
| A.NH4Cl溶液 | B.NaCl溶液 | C.Na2SO4溶液 | D.NaHCO3溶液 |
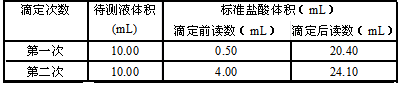
10分)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并____________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填字母序号)。
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |

(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
下列说法正确的是
| A.乙烯的结构简式可以表示为CH2CH2 | B.苯、乙醇和乙酸都能发生取代反应 |
| C.糖类、油脂、蛋白质均为高分子化合物 | D.乙酸不能与NaHCO3溶液反应生成CO2 |
下列物质属于羧酸的是
| A.HCHO | B.CH3COOH | C.CH3CH2OH | D.CH3COOC2H5 |
生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式为
根据所学知识,可以判断
| A.聚苯乙烯能使溴水褪色 |
| B.聚苯乙烯是一种天然高分子化合物 |
| C.聚苯乙烯可由苯乙烯通过化合反应制得 |
| D.聚苯乙烯单体的分子式为C8H8 |
下列试剂的保存方法正确的是
| A.氢氟酸保存在玻璃瓶中 ,烧碱溶液存放在带有玻璃塞的试剂瓶中 |
| B.水玻璃存放在滴瓶中,硝酸银溶液保存在无色广口瓶中。 |
| C.少量金属钠保存在煤油中,少量白磷保存在水中。 |
| D.液溴直接存放在棕色滴瓶中,浓硝酸保存在带橡胶塞的无色玻璃瓶中。 |