题目内容
16.下列物质与酸的反应中,只表现出酸性作用的是( )| A. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | B. | C+4HNO3(浓)═CO2↑+4NO2↑+2H2O | ||
| C. | 3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O | D. | CuO+2HNO3(稀)═Cu(NO3)2+H2O |
分析 酸在反应中只表现出酸性,说明在反应中酸中各元素化合价不变,据此分析解答.
解答 解:A.该反应中,硫酸中部分S元素化合价不变、部分S元素化合价由+6价变为+4价,所以浓硫酸体现酸性和氧化性,故A不选;
B.该反应中,硝酸中N元素化合价由+5价变为+4价,所以硝酸只作氧化剂,故B不选;
C.该反应中,硝酸中部分N元素化合价不变,部分N元素化合价由+5价变为+2价,所以硝酸作氧化剂和酸,体现酸性和强氧化性,故C不选;
D.该反应中,硝酸中N元素化合价不变,所以硝酸只体现酸性,故D选;
故选D.
点评 本题考查硫酸、硝酸的性质,明确元素化合价与性质的关系是解本题关键,根据元素化合价是否变化判断物质性质,熟悉常见元素化合价.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
9.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 11.2LO2和03组成的混合气体含有原子数为NA | |
| B. | 常温常压下,1.7gNH3含有的电子数目为NA | |
| C. | .0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA | |
| D. | 标准状况下,22.4LNO2与足量的H2O充分反应后转移电子数为NA. |
4.下列有关物质结构的表述正确的是( )
| A. | 次氯酸的电子式: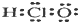 | B. | 氯化钠的分子式:NaCl | ||
| C. | 二氧化碳的比例模型: | D. | Cl-的结构示意图: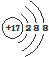 |
8.下列反应中,水作还原剂的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | CaO+H2O═Ca(OH)2 | ||
| C. | 3NO2+H2O═2HNO3+NO | D. | 2F2+2H2O═4HF+O2 |
5.如图所示,锥形瓶内有气体X,分液漏斗内有液体Y,如果Y流下,过一会儿,小气球鼓起,气体X和Y不可能是( )


| A. | X是NH3,Y是KCl溶液 | B. | X是SO2,Y是NaOH | ||
| C. | X是H2,Y是浓硫酸 | D. | X是CO2,Y是KOH |