题目内容
碳、硫的含量影响钢铁性能.碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定.
(1)采用装置A,在高温下将x g钢样中的碳、硫转化为CO2、SO2.
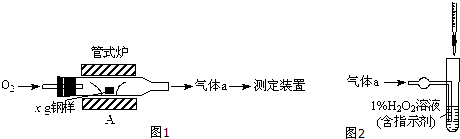
①气体a的成分是 .
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2
1 +3 .
(2)将气体a通入测硫装置中(如图所示),采用滴定法测定硫的含量.
①H2O2氧化SO2的化学方程式: .
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液.若消耗1mL NaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数: .
(3)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:2H2(g)+O2(g)=2H2O(g)△H1=-d kJ?mol-1;2C(s)+O2(g)=2CO(g)△H2=-e kJ?mol-1;碳的燃烧热为f kJ?mol-1(d、e、f均大于0);写出CO与水蒸气反应生成CO2和H2的热化学方程式: .
②将含SO2的烟气通过洗涤剂Y,再加入稀硫酸,既可以回收SO2,同时又可以得到化肥,上述洗涤剂Y可以是 (填序号).
a.Ca(OH)2 b.CaCl2 c.K2CO3 d.NaHSO3 e.NH3?H2O.
(1)采用装置A,在高温下将x g钢样中的碳、硫转化为CO2、SO2.

①气体a的成分是
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2
| ||
(2)将气体a通入测硫装置中(如图所示),采用滴定法测定硫的含量.
①H2O2氧化SO2的化学方程式:
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液.若消耗1mL NaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数:
(3)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:2H2(g)+O2(g)=2H2O(g)△H1=-d kJ?mol-1;2C(s)+O2(g)=2CO(g)△H2=-e kJ?mol-1;碳的燃烧热为f kJ?mol-1(d、e、f均大于0);写出CO与水蒸气反应生成CO2和H2的热化学方程式:
②将含SO2的烟气通过洗涤剂Y,再加入稀硫酸,既可以回收SO2,同时又可以得到化肥,上述洗涤剂Y可以是
a.Ca(OH)2 b.CaCl2 c.K2CO3 d.NaHSO3 e.NH3?H2O.
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)①该装置中C、S和氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余;
②若钢样中碳以FeS形式存在,FeS被氧气氧化,Fe元素化合价由+2价变为+3价,-2价的S被氧化为+4价,结合化学计量数知,生成物是二氧化硫和四氧化三铁;
(2)①双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和水;
②若消耗1mL NaOH溶液相当于硫的质量为y克,z mL NaOH溶液相当于硫的质量为yzg,再根据质量分数公式计算硫的质量分数;
(3)①根据盖斯定律进行计算;
②二氧化硫属于酸性氧化物,能和碱液反应,亚硫酸酸性大于碳酸,所以能和可溶性碳酸盐反应;
②若钢样中碳以FeS形式存在,FeS被氧气氧化,Fe元素化合价由+2价变为+3价,-2价的S被氧化为+4价,结合化学计量数知,生成物是二氧化硫和四氧化三铁;
(2)①双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和水;
②若消耗1mL NaOH溶液相当于硫的质量为y克,z mL NaOH溶液相当于硫的质量为yzg,再根据质量分数公式计算硫的质量分数;
(3)①根据盖斯定律进行计算;
②二氧化硫属于酸性氧化物,能和碱液反应,亚硫酸酸性大于碳酸,所以能和可溶性碳酸盐反应;
解答:
解:(1)①该装置中C、S在A装置中被氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余,所以气体a的成分是SO2、CO2、O2,故答案为:SO2、CO2、O2;
②若钢样中碳以FeS形式存在,FeS被氧气氧化,Fe元素化合价由+2价变为+3价,-2价的S被氧化为+4价,结合化学计量数知,生成物是二氧化硫和四氧化三铁,所以反应方程式为3FeS+5O2
Fe3O4+3SO2,
故答案为:Fe3O4;SO2;
(2)①双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和水,反应方程式为 H2O2+SO2=H2SO4,故答案为:H2O2+SO2=H2SO4;
②若消耗1mL NaOH溶液相当于硫的质量为y克,z mL NaOH溶液相当于硫的质量为yzg,硫的质量分数为
×100%=
×100%,故答案为:
×100%;
(3)①2H2(g)+O2(g)═2H2O(g)△H1=-d kJ?mol-1①
2C(s)+O2(g)═2CO(g)△H2=-e kJ?mol-1②
C(s)+O2(g)═CO2(g)△H3=-f kJ?mol-1③
将方程式
得CO(g)+H2O(g)=CO (g)+H2(g)△H=(0.5d+0.5e-f)kJ?mol-1,
故答案为:CO(g)+H2O(g)=CO (g)+H2(g)△H=(0.5d+0.5e-f)kJ?mol-1;
②二氧化硫属于酸性氧化物,能和碱液反应,亚硫酸酸性大于碳酸,所以能和可溶性碳酸盐反应,加入稀硫酸后能得到二氧化硫且得到化肥,故选ce;
②若钢样中碳以FeS形式存在,FeS被氧气氧化,Fe元素化合价由+2价变为+3价,-2价的S被氧化为+4价,结合化学计量数知,生成物是二氧化硫和四氧化三铁,所以反应方程式为3FeS+5O2
| ||
故答案为:Fe3O4;SO2;
(2)①双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和水,反应方程式为 H2O2+SO2=H2SO4,故答案为:H2O2+SO2=H2SO4;
②若消耗1mL NaOH溶液相当于硫的质量为y克,z mL NaOH溶液相当于硫的质量为yzg,硫的质量分数为
| yzg |
| xg |
| yz |
| x |
| yz |
| x |
(3)①2H2(g)+O2(g)═2H2O(g)△H1=-d kJ?mol-1①
2C(s)+O2(g)═2CO(g)△H2=-e kJ?mol-1②
C(s)+O2(g)═CO2(g)△H3=-f kJ?mol-1③
将方程式
| ①+③ |
| 2 |
故答案为:CO(g)+H2O(g)=CO (g)+H2(g)△H=(0.5d+0.5e-f)kJ?mol-1;
②二氧化硫属于酸性氧化物,能和碱液反应,亚硫酸酸性大于碳酸,所以能和可溶性碳酸盐反应,加入稀硫酸后能得到二氧化硫且得到化肥,故选ce;
点评:本题考查了C、S含量的测定,涉及氧化还原反应、方程式的配平等知识点,明确实验原理是解本题关键,结合物质的性质来分析解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
有0.006%醋酸溶液,其电离度为10%,假设溶液的密度为1g/ml,则下列结论正确的是( )
| A、C(H+)=10-3mol/L |
| B、C(OH-)=10-9mol/L |
| C、pH=4 |
| D、溶液中由水电离的C(H+)=10-10mol/L |

 )
)


 与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.








 ;④CH3COOC2H5;⑤CH3COOH五物质中:
;④CH3COOC2H5;⑤CH3COOH五物质中: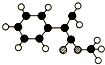 A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(如图中球与球之间连线代表化学键单键或双键).
A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(如图中球与球之间连线代表化学键单键或双键).