题目内容
(1)请将6种物质:NO、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3、H2O分别填入下面对应的横线上,组成一个配平的化学方程式. + → + + +
(2)反应物中发生氧化反应的物质 ,被还原的元素是 .
(3)反应中1mol氧化剂( ) (填“得到”或“失去”) mol电子.
(4)下列反应中,Na2O2只表现强氧化性的是
A.2Na2O2+2H2O═4NaOH+O2↑
B.Na2O2+MnO2═Na2MnO4
C.2Na2O2+2H2SO4═2Na2SO4+2H2O+O2↑
D.5Na2O2+2KMnO4+8H2SO4═5Na2SO4+K2SO4+2MnSO4+5O2↑+8H2O.
(2)反应物中发生氧化反应的物质
(3)反应中1mol氧化剂(
(4)下列反应中,Na2O2只表现强氧化性的是
A.2Na2O2+2H2O═4NaOH+O2↑
B.Na2O2+MnO2═Na2MnO4
C.2Na2O2+2H2SO4═2Na2SO4+2H2O+O2↑
D.5Na2O2+2KMnO4+8H2SO4═5Na2SO4+K2SO4+2MnSO4+5O2↑+8H2O.
考点:氧化还原反应方程式的配平,氧化还原反应
专题:氧化还原反应专题
分析:(1)6种物质:NO、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3、H2O中,硝酸的氧化性大于三价铁离子,所以在该反应中硝酸作氧化剂,在反应中得电子,化合价降低被还原为NO,FeSO4在反应中失电子,化合价升高发生氧化反应,作还原剂,被氧化为:Fe(NO3)3和Fe2(SO4)3,依据得失电子数守恒、原子个数守恒写成化学方程式;
(2)反应物中所含元素化合价升高的发生氧化反应,所含元素化合价降低的发生还原反应;
(3)依据反应中HNO3→NO,氮元素由+5→+2价解答;
(4)Na2O2只表现强氧化性说明氧元素的得电子化合价降低.
(2)反应物中所含元素化合价升高的发生氧化反应,所含元素化合价降低的发生还原反应;
(3)依据反应中HNO3→NO,氮元素由+5→+2价解答;
(4)Na2O2只表现强氧化性说明氧元素的得电子化合价降低.
解答:
解:(1)所给的物质组合中,HNO3中氮元素化合价位于最高价,在反应中得电子,化合价降低被还原为NO,FeSO4在反应中失电子,化合价升高发生氧化反应,作还原剂,被氧化为:Fe(NO3)3和Fe2(SO4)3,根据化合价升降相等和原子守恒配平后发生的反应为:4HNO3+3FeSO4=Fe(NO3)3+Fe2(SO4)3+NO↑+2H2O;
故答案为:4HNO3;3FeSO4;Fe(NO3)3;Fe2(SO4)3;NO↑;2H2O;
(2)反应物中FeSO4在反应中失电子,化合价升高发生氧化反应,HNO3中的N元素化合价降低,发生还原反应,被还原;
故答案为:FeSO4;N;
(3)反应中HNO3得电子,化合价降低被还原为NO,反应中N元素化合价由+5价降低到+2价,则1mol氧化剂得到3mol电子;
故答案为:HNO3;得到;3;
(4)A.反应2Na2O2+2H2O═4NaOH+O2↑中,过氧化钠中氧元素既有得电子化合价降低的,也有失电子化合价升高的,所以过氧化钠既表现氧化性又表现还原性,故A不选;
B.在反应Na2O2+MnO2═Na2MnO4中,过氧化钠中氧元素得电子化合价降低,锰元素失电子化合价升高,过氧化钠作氧化剂,只表现氧化性,故B选;
C.在反应2Na2O2+2H2SO4═2Na2SO4+2H2O+O2↑中,过氧化钠中氧元素既有得电子化合价降低的,也有失电子化合价升高的,所以过氧化钠既表现氧化性又表现还原性,故C不选;
D.在反应5Na2O2+2KMnO4+8H2SO4═5Na2SO4+K2SO4+2MnSO4+5O2↑+8H2O中,过氧化钠中氧元素失电子化合价升高,做还原剂,锰元素得电子化合价降低,做氧化剂,过氧化钠只表现出还原性,故D不选;
故选:B.
故答案为:4HNO3;3FeSO4;Fe(NO3)3;Fe2(SO4)3;NO↑;2H2O;
(2)反应物中FeSO4在反应中失电子,化合价升高发生氧化反应,HNO3中的N元素化合价降低,发生还原反应,被还原;
故答案为:FeSO4;N;
(3)反应中HNO3得电子,化合价降低被还原为NO,反应中N元素化合价由+5价降低到+2价,则1mol氧化剂得到3mol电子;
故答案为:HNO3;得到;3;
(4)A.反应2Na2O2+2H2O═4NaOH+O2↑中,过氧化钠中氧元素既有得电子化合价降低的,也有失电子化合价升高的,所以过氧化钠既表现氧化性又表现还原性,故A不选;
B.在反应Na2O2+MnO2═Na2MnO4中,过氧化钠中氧元素得电子化合价降低,锰元素失电子化合价升高,过氧化钠作氧化剂,只表现氧化性,故B选;
C.在反应2Na2O2+2H2SO4═2Na2SO4+2H2O+O2↑中,过氧化钠中氧元素既有得电子化合价降低的,也有失电子化合价升高的,所以过氧化钠既表现氧化性又表现还原性,故C不选;
D.在反应5Na2O2+2KMnO4+8H2SO4═5Na2SO4+K2SO4+2MnSO4+5O2↑+8H2O中,过氧化钠中氧元素失电子化合价升高,做还原剂,锰元素得电子化合价降低,做氧化剂,过氧化钠只表现出还原性,故D不选;
故选:B.
点评:本题考查氧化还原反应化学方程式的书写,氧化剂还原剂的判断,明确反应中化合价的升降和得失电子的守恒是解题关键,题目难度中等.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
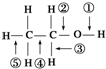 乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )| A、和金属钠反应时键①断裂 |
| B、在铜催化共热下与O2反应时断裂①和③ |
| C、在铜催化共热下与O2反应时断裂①和⑤ |
| D、在空气中完全燃烧时断裂①②③④⑤ |
将102g由氮气和氢气按1:3的物质的量之比组成的混合气体,在一定条件下通入密闭容器中反应,当N2(g)+3H2(g)?2NH3(g)达到平衡后,平衡混合气体平均相对分子质量为12.5,则其中含氨的质量为( )
| A、32.64 g |
| B、65.28 g |
| C、3.84 g |
| D、38.4 g |
加强食品检测是保证食品安全、保护公众利益的重要举措.下列一般不属于食品安全检测指标的是( )
| A、氯气 | B、二氧化硫 |
| C、亚硝酸钠 | D、碘酸钾 |
将煤处理后变为气体燃料的目的是( )
| A、提高煤的价格 |
| B、提高燃烧效率,减少大气污染 |
| C、方便存放 |
| D、方便运输 |