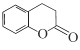
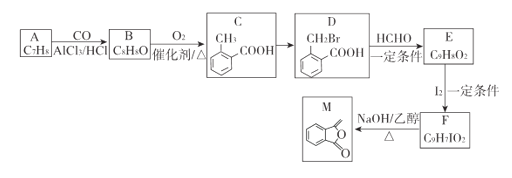
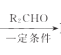
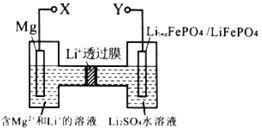
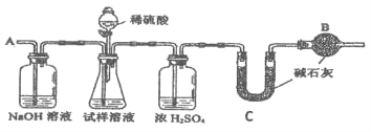
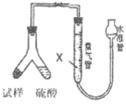
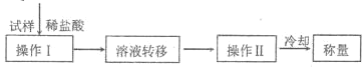
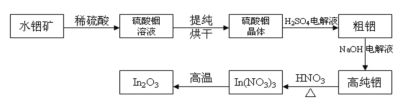
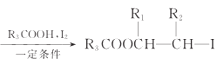题目内容
【题目】已知:25 °C时,MOH的Kb=10-7。该温度下,在20.00 mL0.1 mol· L-1 MCl溶液中滴入0.1 mol·L-1NaOH溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列说法错误的是
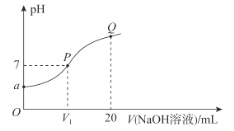
A.a=4B.V1=10
C.溶液中水的电离程度:P>QD.Q点溶液中c(Na+)<2c(M+)
【答案】D
【解析】
A. 25 °C时,MOH的Kb=10-7,则Kh(MCl)=![]() =10-7,解得c(H+)=10-4 mol/L,pH=a=4,A正确;
=10-7,解得c(H+)=10-4 mol/L,pH=a=4,A正确;
B. 等浓度的MCl、MOH的混合溶液中,MCl的水解程度等于MOH的电离程度,所以溶液pH=7时,加入的MOH的体积为10 mL,B正确;
C. 在盐MCl溶液中逐滴加入NaOH溶液,加入的碱越大,水对电离的抑制作用越强,水电离程度就越小,所以溶液中水的电离程度:P>Q,C正确;
D.P点加入10mLNaOH溶液时nP(Na+)=nP(M+),Q点时MOH少量电离,nQ(M+)<nP(M+),nQ(Na+)=2nP(Na+),所以c(Na+)>2c(M+),D错误;
故合理选项是D。

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
【题目】已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是( )
元素编号 | |||||||
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
原子半径 | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
最高正化合价 | 无 |
|
|
|
|
|
|
最低负化合价 |
|
| 无 |
|
| 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.①元素的氢化物有两种
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥