题目内容
3.某金属A及其化合物之间有如下的转化关系: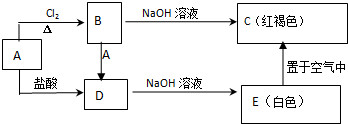
试回答下列问题:
(1)D的溶液与NaOH 溶液混合后的现象是产生白色沉淀,立即变为灰绿色,最后变为红褐色沉淀.
(2)反应B转化成D的离子方程式是Fe+2Fe3+=2Fe2+.
(3)把B溶液滴入沸水中可以得到红褐色的液体,用一束光通过该液体产生丁达尔效应.
分析 根据转化关系可知:红褐色C为Fe(OH)3,根据元素守恒可知金属A为Fe,Fe与氯气反应得到B为FeCl3,Fe与盐酸反应得到D,则D为FeCl2,D和NaOH溶液反应生成的白色E为Fe(OH)2,Fe(OH)2和氧气、水反应生成Fe(OH)3,再结合题目分析解答.
解答 解:红褐色C为Fe(OH)3,根据元素守恒可知金属A为Fe,Fe与氯气反应得到B为FeCl3,Fe与盐酸反应得到D,则D为FeCl2,D和NaOH溶液反应生成的白色E为Fe(OH)2,Fe(OH)2和氧气、水反应生成Fe(OH)3,
(1)D为FeCl2,D和NaOH溶液反应生成的白色E为Fe(OH)2,Fe(OH)2和氧气、水反应生成红褐色的沉淀Fe(OH)3,反应现象为:产生白色沉淀,立即变为灰绿色,最后变为红褐色沉淀,
故答案为:产生白色沉淀,立即变为灰绿色,最后变为红褐色沉淀;
(2)B为FeCl3,D为FeCl2,氯化铁与Fe反应生成氯化亚铁,反应的离子方程式为:Fe+2Fe3+=2Fe2+,
故答案为:Fe+2Fe3+=2Fe2+;
(3)B为FeCl3,把氯化铁溶液滴入沸水中可以得到红褐色的液体,该红褐色液体为氢氧化铁胶体,若用一束光通过该液体会产生丁达尔效应,
故答案为:丁达尔效应.
点评 本题以Fe及其化合物之间的转化为载体考查无机物推断,还涉及离子方程式书写、胶体性质等知识,明确物质性质、基本理论是解本题关键,知道铁离子、亚铁离子的性质及实验现象,题目难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
13.煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g).一定温度下,在一个容积不变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母,下同).
a.容器中的压强不变
b.1mol H-H 键断裂的同时断裂2mol H-O 键
c.混合气体密度不变
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L 的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到数据如下:
实验中以v(CO2) 表示的反应速率为,达平衡时CO 的体积分数为40%.
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下,在体积为1L 的恒容密闭容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
为了加快反应速率,可采取什么措施(写两条)升温、使用催化剂.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g).一定温度下,在一个容积不变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母,下同).
a.容器中的压强不变
b.1mol H-H 键断裂的同时断裂2mol H-O 键
c.混合气体密度不变
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L 的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到数据如下:
| 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |
| 2 | 4 | 1.6 | 2.4 | 5 |
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下,在体积为1L 的恒容密闭容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
为了加快反应速率,可采取什么措施(写两条)升温、使用催化剂.
14.酒后驾车是引发交通事故的重要原因.交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液乙醇迅速生成蓝绿色Cr3+.下列对乙醇的描述与此测定原理有关的是( )
①乙醇易挥发 ②乙醇密度比水小 ③乙醇有还原性 ④75%乙醇溶液常用医疗消毒.
①乙醇易挥发 ②乙醇密度比水小 ③乙醇有还原性 ④75%乙醇溶液常用医疗消毒.
| A. | ②④ | B. | ②③ | C. | ①④ | D. | ①③ |
11.H+浓度相同的两份等体积溶液A和B,A为HCl溶液,B为CH3COOH溶液,二者分别和等质量的锌反应,若最后仅有一份溶液中存在锌,则下列说法正确的是( )
①开始时的反应速率:A>B ②参加反应的锌的物质的量:A=B
③反应过程的平均速率:B>A ④A中有锌剩余 ⑤B中有锌剩余.
①开始时的反应速率:A>B ②参加反应的锌的物质的量:A=B
③反应过程的平均速率:B>A ④A中有锌剩余 ⑤B中有锌剩余.
| A. | ③④ | B. | ③⑤ | C. | ①③④ | D. | ①②③ |
18.某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②CO和CO2都是酸性氧化物;③蔗糖、硫酸钡分别属于非电解质和电解质;④CuO和Fe2O3都是碱性氧化物;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦NaCl和KCl可用焰色反应鉴别.上述说法正确的是( )
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①③④⑦ |
8.下列化工生产过程中所发生的主要化学反应不属于氧化还原反应的是( )
| A. | 用氯气和消石灰制漂白粉 | B. | 铝热法冶炼金属铁 | ||
| C. | 用油脂制肥皂 | D. | 电解水制H2 |
12.与丁醇互为同分异构体的物质是( )
| A. | 乙醚 | B. | 甲醚 | C. | 乙醛 | D. | 乙醇 |
13.下列物质中互为同分异构体的是( )
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | O2与O3 | ||
| C. |  与 与 | D. |  与 与 |