题目内容
将0.2mol/L NaA溶液和0.1mol/L盐酸等体积混合后,溶液pH>7,以下关系式错误的是( )
| A、c(A-)>c(HA) |
| B、c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-) |
| C、c(HA)+c(A-)=0.1mol/L |
| D、c(Na+)=c(A-)+c(HA) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:0.2mol/L NaA溶液和0.1mol/L盐酸等体积混合后,反应后的溶质为等浓度的NaA和HA,根据物料守恒,c(Na+)=c(A-)+c(HA)=0.1mol/L;溶液pH>7,溶液显示碱性,c(H+)<c(OH-),说明HA的电离程度小于A-的水解程度,则c(A-)<c(HA);根据溶液中电荷守恒c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-)可知,c(Na+)>c(A-)+c(Cl-),据此进行解答.
解答:
解:A.将0.2mol/L NaA溶液和0.1mol/L盐酸等体积混合后,溶质是NaA和HA,且二者的浓度相等,而混合液的pH>7,说明HA的电离程度小于A-的水解程度,则c(A-)<c(HA),故A错误;
B.反应后的溶液一定满足电荷守恒,即c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-),故B正确;
C.溶液混合后浓度减小一半,根据物料守恒可得:c(Na+)=c(A-)+c(HA)=0.1mol/L,故C正确;
D.根据物料守恒可知,c(Na+)=c(A-)+c(HA),故D正确;
故选A.
B.反应后的溶液一定满足电荷守恒,即c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-),故B正确;
C.溶液混合后浓度减小一半,根据物料守恒可得:c(Na+)=c(A-)+c(HA)=0.1mol/L,故C正确;
D.根据物料守恒可知,c(Na+)=c(A-)+c(HA),故D正确;
故选A.
点评:本题考查了弱电解质的电离及盐的水解应用、溶液中离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确溶液中离子浓度大小比较的方法.

练习册系列答案
相关题目
下列反应的离子方程式书写正确的是( )
| A、稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| B、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| C、氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
| D、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
新能源的特点是资源丰富,无污染或很少污染,且可以再生.下列属于新能源的是( )
| A、太阳能 | B、石油 | C、天然气 | D、煤 |
下列电离方程式书写错误的是( )
| A、CaCl2=Ca2++2Cl- |
| B、NaHSO4=Na++H++SO42- |
| C、HNO3=H++NO3- |
| D、KOH=K++O2-+H+ |
| E、KOH=K++O2-+H+ |
2006年1月,河南省某电厂柴油泄漏污染黄河水,使山东等省纷纷发布预警,关闭沿河取水口.泄漏的柴油或含油污水进入自然水体后,对水生生物产生很大影响.下列叙述中,错误的是( )
| A、柴油油膜阻止了氧气溶解,使水中氧气得不到补充而缺氧,水质变差 |
| B、油膜粘附在鱼身上,使鱼不能正常生活 |
| C、油污粘附在植物茎叶上,使植物死亡 |
| D、油膜通常很薄,对水生生物的影响极其微小 |
下列各组试剂(括号内的是滴加试剂)做溶液导电性实验的过程中,可以观察到灯泡由亮变暗直至熄灭,然后又逐渐变亮的是( )
| A、BaCl2溶液(稀硫酸) |
| B、氨水(醋酸溶液) |
| C、Ba(OH)2溶液[Ba(HCO3)2溶液] |
| D、Ba(OH)2溶液(NaHSO4溶液) |
下列有机物的命名正确的是( )
A、 :2,2,4三甲基戊烷 :2,2,4三甲基戊烷 |
| B、CH3CHO:甲酸 |
C、 :2乙基3丁烯 :2乙基3丁烯 |
D、 :2-羟基丁烷 :2-羟基丁烷 |
下列物质既能发生消去反应,又能氧化成醛的是( )
| A、CH3CHOHCH3 |
B、 |
C、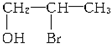 |
D、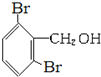 |