题目内容
【题目】碳族元素的单质及其化合物是一类重要物质。请回答下列问题:
(1)锗(Ge)是用途很广的半导体材料,基态Ge原子的核外电子中,有_____个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________________________________。
(3)GeCl4可水解生成一种氧化物和一种无氧酸,其化学反应方程式为:_______________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为______,微粒之间存在的作用力是_______。
(6)合成氮化碳是一种硬度比金刚石还大的晶体,氮化碳的晶体类型为________,该晶体中微粒间的作用力是____________。
(7)COCl2俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为____________,其中碳氧原子之间共价键是________(填序号)。
a.2个σ键b.2个π键c.1个σ键,1个π键
(8) CaC2中C22与O22+互为等电子体,O22+的电子式可表示为________。
【答案】2 Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键; GeCl4+2H2O=4HCl+GeO2 O>Ge>Zn sp3 共价键 原子晶体 共价键  c
c ![]()
【解析】
(1)Ge是32号元素,位于第四周期第IVA族,基态Ge原子核外电子排布式为[Ar]3d104s24p2;
(2)Ge原子半径大,难以通过“肩并肩”方式形成π键;
(3)GeCl4可水解生成HCl和GeO2;
(4)元素的非金属性越强,吸引电子的能力越强,元素的电负性越大;
(5)Ge单晶具有金刚石型结构,Ge原子与周围4个Ge原子形成正四面体结构,向空间延伸的立体网状结构,属于原子晶体;
(6) 根据物理性质判断晶体类型,根据非金属原子间形成共价键分析;
(7) COCl2俗称光气,分子中C原子采取sp2杂化成键,C原子与氯原子之间形成C-Cl单键,故C原子与O原子之间形成C=O双键,双键中含有1个σ键、1个π键;
(8) 等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键。
(1)Ge是32号元素,位于第四周期第IVA族,基态Ge原子核外电子排布式为1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2,在最外层的4s能级上2个电子为成对电子,4p轨道中2个电子分别处以不同的轨道内,有2轨道未成对电子;
(2)虽然Ge与C是同族元素,C原子之间可以形成双键、叁键,但考虑Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键,所以Ge原子之间难以形成双键或叁键;
(3)GeCl4可水解生成一种氧化物和一种无氧酸,其化学反应方程式为:GeCl4+2H2O=4HCl+GeO2;
(4)元素非金属性:Zn<Ge<O,元素的非金属性越强,吸引电子的能力越强,元素的电负性越大,故电负性:O>Ge>Zn;
(5)Ge单晶具有金刚石型结构,Ge原子与周围4个Ge原子形成正四面体结构,向空间延伸的立体网状结构,属于原子晶体,Ge原子之间形成共价键,Ge原子杂化轨道数目为4,采取sp3杂化;
(6)氮化碳是一种硬度比金刚石还大的晶体材料,则氮化碳具有原子晶体的性质,所以属于原子晶体;非金属原子间形成共价键,所以N与C之间形成共价键;
(7)COCl2俗称光气,分子中C原子采取sp2杂化成键,C原子与氯原子之间形成CCl单键,故C原子与O原子之间形成C=O双键,光气分子的结构式是![]() ,C=O双键中含有1个σ键、1个π键,答案选c;
,C=O双键中含有1个σ键、1个π键,答案选c;
(8)根据等电子体的结构相似,O22+的电子式与C22的电子式相似,含有2个π键,O22+的电子式![]() 。
。

【题目】CoCl2可用于电镀,是一种性能优越的电池前驱材料,由含钴矿(Co元素主要以Co2O3、CoO存在,还含有Fe、Si、Cu、Zn、Mn、Ni、Mg、Ca元素)制取氯化钴晶体的一种工艺流程如下:
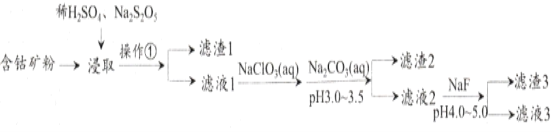
已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110—120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
Co3+ | Fe3+ | Cu2+ | Co2+ | Fe2+ | Zn2+ | Mn2+ | Mg2+ | |
开始沉淀pH | 0.3 | 2.7 | 5.5 | 7.2 | 7.6 | 7.6 | 8.3 | 9.6 |
完全沉淀pH | 1.1 | 3.2 | 6.6 | 9.2 | 9.6 | 9.2 | 9.3 | 11.1 |
回答下列问题:
(1)操作①的名称为_________,NaClO3具有氧化性,其名称为__________________。
(2)浸取中加入Na2S2O5的作用是___________________________。
(3)滤液1中加入NaClO3/span>的作用是_______________________________________,相关的离子方程式为__________________________________________。
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为___________________________。
(5)滤渣3主要成分为________________________(写化学式)。
滤液3经过多次萃取与反萃取制备CoCl2晶体
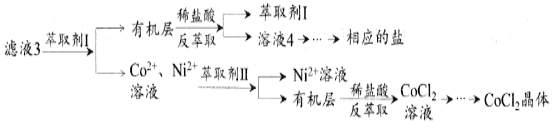
(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是_______________________。
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是_________________________________。