题目内容
3.氮元素可以形成多种化合物.回答以下问题:(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①NH3分子的空间构型是三角锥形;N2H4分子中氮原子轨道的杂化类型是sp3.
②肼可用作火箭燃料,燃烧时发生的反应是:${N_2}{O_4}(l)+2{N_2}{H_4}(l)═3{N_2}(g)+4{H_2}O(g)\;△H=-1038.7kJ•mo{l^{-1}}$
若该反应中有4molN-H键断裂,则形成的π键有3mol.
③肼能与硫酸反应形成N2H6SO4.N2H6SO4晶体类型与硫酸铵相同.则N2H6SO4的晶体内不存在d(填标号)
a 离子键 b 共价键 c 配位键 d 范德华力
(2)图1表示某种含氮有机化合物的结构,其分子内四个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别.
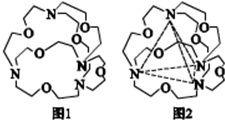
下列分子或离子中,能被该有机化合物识别的是c(填标号).
a.CF4 b.CH4 c.$N{H_4}^+$ d.H2O.
分析 (1)①根据价层电子对互斥理论确定分子空间构型和原子的杂化方式;
②根据氮氢键和生成气体、π键之间的关系式计算;
③根据硫酸铵晶体中存在的化学键判断;
(2)能被该有机物识别即能嵌入空腔形成4个氢键,则要求某分子或离子是正四面体结构且能形成氢键,据此解题.
解答 解:(1)①NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥形;N2H4分子中氮原子的加成电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3,故答案为:三角锥形;sp3;
②若该反应中有4mol N-H键断裂,则有1molN2H4参加反应,生成氮气1.5mol,形成的π键有1.5mol×2=3mol,故答案为:3;
③硫酸铵是离子化合物,硫酸铵中存在离子键和共价键,N2H6SO4晶体类型与硫酸铵相同,所以N2H6SO4的晶体内存在离子键和共价键,不含金属键和范德华力,故答案为:d;
(2)要形成氢键,就要掌握形成氢键的条件:一是要有H原子,二是要电负性比较强,半径比较小的原子比如F、O、N等构成的分子间形成的特殊的分子间作用力,符合这样的选项就是c和d,但题中要求形成4个氢键,氢键具有饱和性,这样只有选c,故答案为:c.
点评 本题考查较综合,涉及空间构型的判断、晶体中存在的化学键、氢键的成键特征等知识点,分子空间构型是考试热点,注意氢键具有饱和性,题目难度不大,要注重基础知识的积累.

练习册系列答案
相关题目
14.下列物质中属于酚的是( )
| A. |  | B. |  | C. |  | D. | CH3CH2OH |
11.下列物质与CH3CH2OH互为同系物的是( )
| A. | H-OH | B. | CH3OH | C. | C6H5OH | D. | C2H5OCH2OH |
18.下列物质可以治疗胃酸的是( )
| A. | 氢氧化钙 | B. | 氢氧化铝 | C. | 氧化钙 | D. | 碳酸钡 |
8.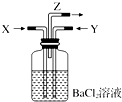 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )| A. | 在Z导管出来的气体中一定有二氧化碳 | |
| B. | 洗气瓶中产生的沉淀是碳酸钡 | |
| C. | 洗气瓶中产生的沉淀是亚硫酸钡和碳酸钡 | |
| D. | 在Z导管的出口处会有无色气体出现 |
13.在一定条件下,甲苯可生成二甲苯混合物和苯.有关物质的沸点、熔点如表:
下列说法不正确的是( )
| 对二甲苯 | 邻二甲苯 | 间二甲苯 | 苯 | |
| 沸点/℃ | 138 | 144 | 139 | 80 |
| 熔点/℃ | 13 | 25 | 47 | 6 |
| A. | 该反应属于取代反应 | |
| B. | 用蒸馏的方法可将苯从反应所得产物中首先分离出来 | |
| C. | 甲苯的沸点高于144℃ | |
| D. | 从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来 |
 如图是铜与稀硝酸反应的实验装置,请回答下列问题:
如图是铜与稀硝酸反应的实验装置,请回答下列问题: 则其结构简式为:CH3CH(CH3)CH2CH2CH3,CH3CH2CH(CH3)CH2CH3.
则其结构简式为:CH3CH(CH3)CH2CH2CH3,CH3CH2CH(CH3)CH2CH3.