题目内容
常温下,四个容积为20L的容器中分别装有下列气体,产生的压强最大的是( )
| A、5 gH2 |
| B、24 gHCl |
| C、48 g SO2 |
| D、55 g CO2 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:相同温度下,体积相等的不同气体,其压强与物质的量成正比,根据n=
进行计算判断.
| m |
| M |
解答:
解:相同温度下,体积相等的不同气体,其压强与物质的量成正比,只要气体的物质的量最大,则其压强最大,5g氢气的物质的量=
=
=2.5mol;
24gHCl物质的量=
=0.66mol;
48g二氧化硫物质的量=
=0.75mol;
55g二氧化碳物质的量=
=1.25mol;
通过以上分析知,物质的量最大的是氢气,则压强最大的是氢气,
故选A.
| m |
| M |
| 5g |
| 2g/mol |
24gHCl物质的量=
| 24g |
| 36.5g/mol |
48g二氧化硫物质的量=
| 48g |
| 64g/mol |
55g二氧化碳物质的量=
| 55g |
| 44g/mol |
通过以上分析知,物质的量最大的是氢气,则压强最大的是氢气,
故选A.
点评:本题考查阿伏伽德罗定律及其推论,明确相同温度、相同条件下,气体压强和物质的量的关系即可解答,题目难度不大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
下列物质中既能与盐酸又能与氢氧化钠溶液反应的是( )
| A、CuO |
| B、Na2CO3 |
| C、Fe2O3 |
| D、Al(OH)3 |
要除去Na2CO3溶液中含有的少量NaHCO3杂质,所选试剂最好是( )
| A、澄清的石灰水 |
| B、Ba(OH)2溶液 |
| C、NaOH溶液 |
| D、盐酸 |
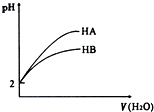 pH=2的两酸HA、HB加水稀释后,溶液pH随加水量的变化曲线如图所示.则下列叙述正确的是( )
pH=2的两酸HA、HB加水稀释后,溶液pH随加水量的变化曲线如图所示.则下列叙述正确的是( )| A、电离平衡常数HA>HB |
| B、等体积的HA和HB与等浓度的NaOH反应,HA消耗的NaOH多 |
| C、等体积的HA和HB与等质量的Zn反应,HA反应速率大 |
| D、另取0.1mol/L上面两酸HA、HB加水稀释100倍后,则酸性HB>HA |
若要配制250mL溶液,应选用的容量精密的仪器的是( )
| A、500L的容量瓶 |
| B、250mL的烧杯 |
| C、250mL的容量瓶 |
| D、250mL的量筒 |
有关等物质的量的
C和
C叙述中正确的是( )
①含有相同数目的原子;
②含有相同物质的量的质子;
③属于同种元素;
④具有相同的质量;
⑤中子数相等;
⑥电子数相等;
⑦相同的化学性质.
12 6 |
14 6 |
①含有相同数目的原子;
②含有相同物质的量的质子;
③属于同种元素;
④具有相同的质量;
⑤中子数相等;
⑥电子数相等;
⑦相同的化学性质.
| A、只有②③⑤ |
| B、除④、⑤均正确 |
| C、只有①②③ |
| D、全部正确 |
100mL 0.6mol?L-1 Al2(SO4)3溶液,其中Al3+浓度最接近于( )
| A、0.18mol?L-1 |
| B、0.12mol?L-1 |
| C、1.2mol?L-1 |
| D、0.6mol?L-1 |
下列物质属于电解质的是( )
| A、NH3 |
| B、Cu |
| C、NaOH |
| D、酒精 |
(双项)已知铍(Be)的原子序数为4,下列对铍及其化合物叙述正确的是( )
| A、铍的金属性比钠弱 |
| B、氯化铍的氧化性比氯化锂强 |
| C、氢氧化铍的碱性比氢氧化钙的强 |
| D、单质铍易跟冷水反应产生H2 |