题目内容
生活污水采用“超滤+反渗透”工艺进行处理后,再对水中的盐分进行处理,可供二次使用.
(1)污水通过超滤系统时,需向进水中加入适量NaClO溶液,其作用是 .
(2)经超滤系统处理后,水中的余氯大部分以游离态存在(余氯可近似看作游离态氯),其中约有1/3与水反应,有关反应的化学方程式是 .加入亚硫酸氢钠可除去水中余氯,反应的离子方程式是 .
(3)反渗透过程中水的回收率为75%~80%,同时生成浓盐水,此浓盐水的含盐浓度是进水含盐浓度的 倍(忽略此过程离子的损失).由于浓盐水中离子浓度较大,极易形成沉淀,在反渗透膜表面析出,使反渗透膜透水率下降.已知:Ksp(CaCO3)约为8.7×10-9,若浓盐水中c(CO32-)约为3.0×10-4mol?L-1,则c(Ca2+)最大不得超过 mol?L-1.
(4)硬度的表示方法是:将水中的Ca2+和Mg2+都看成Ca2+,并将其折算成CaO的质量.通常把1L水中含有10mgCaO称为1度,8度以上为硬水,8度以下为软水.取某水样10mL,经实验测定其中含钙离子0.001g,含镁离子0.00048g,则此水样为 度.用钠离子交换树脂对硬水进行软化处理的原理是 .
(1)污水通过超滤系统时,需向进水中加入适量NaClO溶液,其作用是
(2)经超滤系统处理后,水中的余氯大部分以游离态存在(余氯可近似看作游离态氯),其中约有1/3与水反应,有关反应的化学方程式是
(3)反渗透过程中水的回收率为75%~80%,同时生成浓盐水,此浓盐水的含盐浓度是进水含盐浓度的
(4)硬度的表示方法是:将水中的Ca2+和Mg2+都看成Ca2+,并将其折算成CaO的质量.通常把1L水中含有10mgCaO称为1度,8度以上为硬水,8度以下为软水.取某水样10mL,经实验测定其中含钙离子0.001g,含镁离子0.00048g,则此水样为
考点:难溶电解质的溶解平衡及沉淀转化的本质,氧化还原反应,离子交换
专题:
分析:(1)次氯酸根有强氧化性,能够杀菌消毒;
(2)氯气能够和水反应,生成盐酸和次氯酸;亚硫酸根能够被氯气氧化为硫酸根;
(3)水的回收率为75%~80%,生成浓盐水只有20%~25%,盐的量没有变化;据Ksp(CaCO3)=c(CO32-)?c(Ca2+)计算;
(4)据10mL溶液中含有镁离子的质量计算出其物质的量,则可以看成钙离子的物质的量,钙离子的总物质的量等于CaO的物质的量,求算出其质量即可;钠离子交换树脂就是用钠离子交换其他离子.
(2)氯气能够和水反应,生成盐酸和次氯酸;亚硫酸根能够被氯气氧化为硫酸根;
(3)水的回收率为75%~80%,生成浓盐水只有20%~25%,盐的量没有变化;据Ksp(CaCO3)=c(CO32-)?c(Ca2+)计算;
(4)据10mL溶液中含有镁离子的质量计算出其物质的量,则可以看成钙离子的物质的量,钙离子的总物质的量等于CaO的物质的量,求算出其质量即可;钠离子交换树脂就是用钠离子交换其他离子.
解答:
解:(1)向污水中加入适量NaClO溶液,就是利用次氯酸根的强氧化性对水进行杀菌消毒,故答案为:杀菌消毒;
(2)氯气能够和水反应,生成盐酸和次氯酸,化学方程式为:Cl2+H2O?HClO+HCl;亚硫酸根能够被氯气氧化为硫酸根,本身被还原为氯离子,离子方程式为:HSO3-+Cl2=2Cl-+SO42-+3H+,故答案为:Cl2+H2O?HClO+HCl;HSO3-+Cl2=2Cl-+SO42-+3H+;
(3)水的回收率为75%~80%,生成浓盐水只有20%~25%,盐的量没有变化,所以其浓度变为原来的4~5倍;Ksp(CaCO3)=c(CO32-)?c(Ca2+),则有8.7×10-9=3.0×10-4?c(Ca2+),c(Ca2+)=2.9×10-5,故答案为:4~5,2.9×10-5;
(4)含镁离子0.00048g,为
=0.00002mol,则相当于CaO0.00002mol,质量为0.00002g×56g/mol=0.00112g,含钙离子0.001g则相当于含CaO的质量为0.0014g,10mL水中含有CaO2.52mg,所以水的硬度为25.2;钠离子交换树脂就是用钠离子交换其他离子,
故答案为:25.2;水中的钙离子和镁离子被吸附在离子交换树脂表面,钠离子从离子交换树脂表面进入水中.
(2)氯气能够和水反应,生成盐酸和次氯酸,化学方程式为:Cl2+H2O?HClO+HCl;亚硫酸根能够被氯气氧化为硫酸根,本身被还原为氯离子,离子方程式为:HSO3-+Cl2=2Cl-+SO42-+3H+,故答案为:Cl2+H2O?HClO+HCl;HSO3-+Cl2=2Cl-+SO42-+3H+;
(3)水的回收率为75%~80%,生成浓盐水只有20%~25%,盐的量没有变化,所以其浓度变为原来的4~5倍;Ksp(CaCO3)=c(CO32-)?c(Ca2+),则有8.7×10-9=3.0×10-4?c(Ca2+),c(Ca2+)=2.9×10-5,故答案为:4~5,2.9×10-5;
(4)含镁离子0.00048g,为
| 0.00048g |
| 24g/mol |
故答案为:25.2;水中的钙离子和镁离子被吸附在离子交换树脂表面,钠离子从离子交换树脂表面进入水中.
点评:本题考查了次氯酸根的消毒作用、氧化还原反应化学方程式和离子方程式的书写、沉淀溶度积的计算、水的硬度计算,题目难度中等.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
符合如图中阴影部分的物质是( )


| A、Na2CO3 |
| B、Cu2(OH)2CO3 |
| C、NaCl |
| D、NaHSO4 |
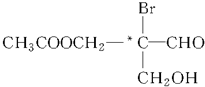 下列有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是( )
下列有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是( )| A、与乙酸发生酯化反应 |
| B、在稀硫酸作用下水解 |
| C、与银氨溶液作用发生银镜反应 |
| D、催化剂作用下与H2反应 |
下列各组离子能大量共存于同一溶液中,且加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的是( )
| A、Ba2+、Mg2+、NO3-、CO32- |
| B、Na+、Al3+、Cl-、AlO2- |
| C、Ba2+、K+、Cl-、HCO3- |
| D、NH4+、Fe3+、Ba2+、Cl- |
下列离子方程式书写正确的是 ( )
| A、银氨溶液中加入足量盐酸产生沉淀[Ag(NH3)2]-+OH-+3H++Cl-═AgCl↓+2NH4++H2O |
| B、在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解3BaSO3+2H++2NO3-═3BaSO4↓+2NO↑+H2O |
| C、孔雀石可溶于盐酸 CO32-+2H+═CO2↑+H2O |
| D、氧化铁可溶于氢碘酸 Fe2O3+6H+═2Fe3++3H2O |
在某无色透明的且能使石蕊试剂变红的溶液中,能大量共存的离子组是( )
| A、K+、SO42-、HCO3- |
| B、K+、SO42-、NO3- |
| C、Fe2+、Cl-、NO3- |
| D、Fe3+、ClO-、Cl- |
 结构,苯环上含有两个取代基,且在核磁共振氢谱中只出现4种峰的所有物质的结构简式为:
结构,苯环上含有两个取代基,且在核磁共振氢谱中只出现4种峰的所有物质的结构简式为: (1)选择下列物质:①MgCl2②金刚石③NH4Cl④KNO3⑤干冰⑥单质碘晶体,按要求填空.(填序号)
(1)选择下列物质:①MgCl2②金刚石③NH4Cl④KNO3⑤干冰⑥单质碘晶体,按要求填空.(填序号)