题目内容
13.要除去MnC12溶液中的Cu2十,Pb2+,Cd2+等金属离子,可通过添加过量难溶电解质MnS,使这些金属离子形成硫化物沉淀而除去.根据上述事实,可推知MnS具有的相关性质是( )| A. | 具有吸附性 | B. | 溶解度与CuS、PbS、Cd相同 | ||
| C. | 溶解度小于CuS,PbS、Cd | D. | 溶解度大于CuS,PbS,CdS |
分析 由信息可知,添加过量难溶电解质MnS,使这些金属离子形成硫化物沉淀而除去,发生沉淀的转化,向溶解度更小的方向移动,以此来解答.
解答 解:由信息可知,添加过量难溶电解质MnS,使这些金属离子形成硫化物沉淀而除去,发生沉淀的转化,则MnS的溶解度大于CuS、PbS、CdS,与吸附性无关,
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握沉淀转化与溶解度的关系为解答的关键,侧重分析与应用能力的考查,注意同类型的难溶电解质Ksp小的溶解度就小,题目难度不大.

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
3.下列描述中,错误的是( )
| A. | 电解MgCl2饱和溶液,可制得Cl2,但得不到镁 | |
| B. | 镁与稀盐酸反应剧烈,加入碳酸钠晶体可以减慢反应速率 | |
| C. | 电解饱和食盐水制氯气时用铁作阳极 | |
| D. | 电解法精炼粗铜,用纯铜作阴极 |
4.下列说法正确的是( )
| A. | 氧化还原反应中,一定有一种元素被氧化,另一种元素被还原 | |
| B. | 物质所含元素的化合价越高,该物质的氧化性就越强 | |
| C. | HClO既有氧化性,又有还原性 | |
| D. | 1molCl2参加反应转移2mol电子 |
1.甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料.
(1)以下是工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H
?下表所列数据是该反应在不同温度下的化学平衡常数(K).
由表中数据判断反应I为放热反应(填“吸”或“放”).
?某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1 kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2 kJ/mol
③H2O(g)=H2O(l)△H3 kJ/mol
则反应 CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=(△H1-△H2+4△H3)/2kJ/mol(用△H1、△H2、△H3表示)
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72?)时,实验室利用如图装置模拟该法:
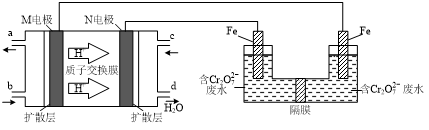
①N电极的电极反应式为O2+4e?+4H+=2H2O.
②请完成电解池中Cr2O72?转化为Cr3+的离子反应方程式:
Cr2O72?+6Fe2++14H+═2Cr3++6Fe3++7H2O
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10?5mol•L-1 时,Cr3+沉淀完全,此时溶液的pH=5.6. (已知,Ksp=6.4×10?31,lg2=0.3)
(1)以下是工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H
?下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
?某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1 kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2 kJ/mol
③H2O(g)=H2O(l)△H3 kJ/mol
则反应 CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=(△H1-△H2+4△H3)/2kJ/mol(用△H1、△H2、△H3表示)
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72?)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为O2+4e?+4H+=2H2O.
②请完成电解池中Cr2O72?转化为Cr3+的离子反应方程式:
Cr2O72?+6Fe2++14H+═2Cr3++6Fe3++7H2O
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10?5mol•L-1 时,Cr3+沉淀完全,此时溶液的pH=5.6. (已知,Ksp=6.4×10?31,lg2=0.3)
8.在密闭容器中发生反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡时的1.7倍.下列叙述中不正确( )
| A. | 平衡向逆反应方向移动 | B. | a<c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率下降 |
18.下列化学方程式不正确的是( )
| A. | 乙醇与浓氢溴酸反应:CH3CH2OH+HBr $\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热:CH3CH2Br+NaOH$\stackrel{△}{→}$CH3CH2OH+NaBr | |
| C. | 苯酚钠溶液中通入少量二氧化碳: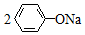 +CO2→ +CO2→ +Na2CO3 +Na2CO3 | |
| D. | 蔗糖在稀硫酸作用下水解:C12H22O11(蔗糖)+H2O$→_{△}^{稀硝酸}$C6H12O6(葡萄糖)+C6H12O6(果糖) |
5.发酵粉的主要成分是酒石酸和( )
| A. | CaSO4 | B. | NaHCO3 | C. | NaCl | D. | Na2SO4 |
2.化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
| A. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| B. | 大力推广燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 | |
| C. | 海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 | |
| D. | 我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
3.下列图示实验能达到实验目的是( )


| A. | 制备少量O2 | B. | 制备无水氯化铁 | ||
| C. | 比较元素非金属性强弱 | D. | 收集氨气 |