题目内容
20.D、E为中学化学常见的金属单质,F是一种黑色晶体.E与C的浓溶液在常温作用无明显现象,加热时则有大量无色气体产生,同时生成H.在一定条件下C、D间能发生反应.各物质转化关系如图: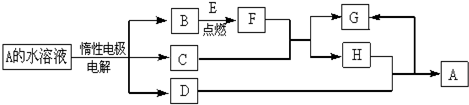
(1)已知1g E在B中燃烧放出的热量为Q kJ,试写出表示E燃烧热的热化学方程式Fe(s)+$\frac{2}{3}$O2(g)=$\frac{1}{3}$Fe3O4(s)△H=-56Q kJ/mol.
(2)检验H和G的混合溶液中含有G的阳离子的试剂可以是:C.
A.氯水和KSCN溶液 B.氢氧化钠溶液 C. 酸性KMnO4溶液
(3)用惰性电极电解一定浓度的A的水溶液,阳极反应式为4OH--4e-=2H2O+O2↑,
通电一段时间后,向所得溶液中加入8.0g D的氧化物后恰好恢复到电解前的浓度和pH,则电解过程中收集到标准状况下的气体体积为1.12L.
(4)假设用以铂做电极,KOH溶液为电解质溶液的肼(N2H4)-气燃料电池作为本过程的电源,则放电时的负极反应式N2H4+4OH--4e-=N2+4H2O(生成物均无污染).
分析 电解A溶液生成三种物质,且D为金属,A应为不活泼金属的含氧酸盐,电解时,在阴极生成金属,则阳极应生成O2,其中E可在B中燃烧说明B为O2,C应为含氧酸,B与E反应得到F是一种黑色晶体,F为氧化物,F与酸反应后生成两种盐,说明金属为变价金属,则E应为Fe,则C应为H2SO4,不可能为硝酸,否则四氧化三铁与硝酸反应只生成一种物质,故F为Fe3O4,G为FeSO4,H为Fe2(SO4)3,D应为Cu,则A应为CuSO4,据此解答.
解答 解:电解A溶液生成三种物质,且D为金属,A应为不活泼金属的含氧酸盐,电解时,在阴极生成金属,则阳极应生成O2,其中E可在B中燃烧说明B为O2,C应为含氧酸,B与E反应得到F是一种黑色晶体,F为氧化物,F与酸反应后生成两种盐,说明金属为变价金属,则E应为Fe,则C应为H2SO4,不可能为硝酸,否则四氧化三铁与硝酸反应只生成一种物质,故F为Fe3O4,G为FeSO4,H为Fe2(SO4)3,D应为Cu,则A应为CuSO4.
(1)已知1g Fe在氧气中燃烧放出的热量为Q kJ,表示Fe燃烧热的热化学方程式为:Fe(s)+$\frac{2}{3}$O2(g)=$\frac{1}{3}$Fe3O4(s)△H=-56Q kJ/mol,
故答案为:Fe(s)+$\frac{2}{3}$O2(g)=$\frac{1}{3}$Fe3O4(s)△H=-56Q kJ/mol;
(2)Fe2+具有还原性,可与酸性高锰酸钾溶液发生氧化还原反应,可用高锰酸钾检验,由于铁离子存在,用氯水和KSCN溶液、氢氧化钠溶液无法检验亚铁离子,
故答案为:C;
(3)用惰性电极电解一定浓度的CuSO4的水溶液,电解时,在阴极生成金属,则阳极应生成O2,阳极反应式为:4OH--4e-=2H2O+O2↑,
电一段时间后,向所得溶液中加入8.0g CuO后恰好恢复到电解前的浓度和pH,而电解过程相当于析出CuO,故生成氧气为$\frac{1}{2}$×$\frac{8g}{80g/mol}$=0.05mol,则电解过程中收集到标准状况下的气体体积为0.05mol×22.4L/mol=1.12L,
故答案为:4OH--4e-=2H2O+O2↑;1.12L;
(4)假设用以铂做电极,KOH溶液为电解质溶液的肼(N2H4)-气燃料电池作为本过程的电源,生成物均无污染,应生成氮气与水,负极发生氧化反应,在N2H4负极失去电子,碱性条件下生成氮气与水,放电时的负极反应式:N2H4+4OH--4e-=N2+4H2O,
故答案为:N2H4+4OH--4e-=N2+4H2O.
点评 本题考查无机物的推断,根据电解产物的进行推断,需要学生熟练掌握元素化合物性质,需要学生具备扎实的基础,题目难度中等.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案| A. | 1molCO2通入750mL 2mol/LKOH溶液中:(K+)=2 c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 加入铝粉有气泡产生的溶液中存在离子:Na+、NH4+、Fe2+、NO3- | |
| C. | 等物质的量Na2CO3、Ca(OH)2、HCl物质混合反应的离子方程式:CO32-+Ca2++H++OH-=CaCO3↓+H2O | |
| D. | Ca与O元素形成化合物中只有离子键 |
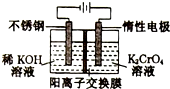 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )| A. | 在阳极室,通电后溶液逐渐由橙色变为黄色 | |
| B. | 电路中有0.2mol电子通过时,阳极与阴极溶液减少的质量差为1.4g | |
| C. | 若测得右室中K与Cr的物质的量之比为3:2,则此过程电路中共转移电子数为0.1NA | |
| D. | 若测定阳极液中K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d |
| A. | 等物质的量的OH-与羟基(-OH)所含电子数相等 | |
| B. | 常温常压下,44 g CO2气体含有氧原子的个数为2 NA | |
| C. | 1 L 0.5 mol•L-1NaHCO3溶液中含有HCO3-的个数为0.5 NA | |
| D. | 11.2 g铁粉与稀硝酸反应转移电子数一定为0.6 NA |
| A. | 电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移 | |
| B. | 含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022 | |
| C. | 28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子 | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022 |
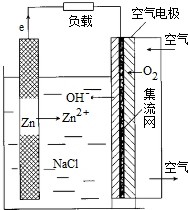
| A. | 放电时,电池正极反应式为:O2+H++4e-=2H2O | |
| B. | 增大空气进气口直径,可增大电池输出能力并延长电池使用寿命 | |
| C. | 放电时,每通入2.24L空气(标准状况),理论上负极需要消耗13gZn | |
| D. | 电池用完后,只需更换封装好的锌粉或电池锌板即可 |

下列说法不正确的是( )
| A. | 收集到的V L气体都是NO | |
| B. | 过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒 | |
| C. | 操作Ⅱ应是洗涤 | |
| D. | 根据题中已知条件不能求出合金中铜的质量分数 |
| A. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 0.2mol S在空气中充分燃烧,转移电子数为0.6NA | |
| C. | 0.1molCl2与足量的水充分反应,转移电子数为0.1NA | |
| D. | 1.5molNa2O2与足量的二氧化碳充分反应,转移电子数为1.5NA |
 海洋是巨大的资源宝库,具有美好的前景.
海洋是巨大的资源宝库,具有美好的前景. 所示.
所示.