题目内容
18.下列关于气体摩尔体积说法正确的是( )| A. | 22.4L任何气体,其物质的量均为1mol | |
| B. | 非标准状况下,l mol任何气体体积一定不是22.4L | |
| C. | 0.6mol H2、0.2mo1 O2和0.2mol CO2组成的混合气体在标况下体积约22.4L | |
| D. | 气体摩尔体积指的是在标准状况下1mol气体的体积 |
分析 A、体积一定,影响气体物质的量的因素有温度、压强;
B、由pV=nRT可知,不是标准状况下,气体摩尔体积也可以是22.4L/mol;
C、标准状况下气体摩尔体积是22.4L/mol,适用于单一气体和混合气体;
D、根据气体摩尔体积的定义判断.
解答 解:A、体积一定,影响气体物质的量的因素有温度、压强,22.4 L任何气体的物质的量可能为1 mol,可能不是1mol,故A错误;
B、由pV=nRT可知,不是标准状况下,1 mol任何气体可能占有22.4 L体积,故B错误;
C、标准状况下气体摩尔体积是22.4L/mol,0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体共1mol,混合气体的体积为22.4L,故C正确;
D、气体摩尔体积是单位物质的量的气体所占的体积,不一定在标准状况下,故D错误.故选C.
点评 本题考查学生对气体摩尔体积的理解,难度不大,注意气体摩尔体积的使用条件与范围.

练习册系列答案
相关题目
8.某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)abe.
Ⅱ.测定中和热的实验装置如图所示

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如表.
①请填写下表中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5 kJ/mol(取小数点后一位).
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如表.
①请填写下表中的空白:
| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
9.在下列溶液中,各组离子一定能大量共存的是( )
| A. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| B. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| C. | 碳酸氢钠溶液中:K+、ClO-、Cl-、OH- | |
| D. | 使酚酞变红的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32- |
6. 对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
 对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )| A. | m+n<p | B. | n>p | ||
| C. | x点的状态是v正>v逆 | D. | 以上答案都错误 |
13.已知Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ/mol,平衡常数为K;测得在不同温度下,K值如下:
(1)该反应的平衡常数表达式K=$\frac{c(CO)}{c(CO{\;}_{2})}$
(2)方程式中的a大于0(填“大于”“小于”或“等于”).
(3)700℃上述反应达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有BC(填序号)
A.缩小反应器体积 B.通入CO2 C.升高温度到900℃D.使用合适的催化剂.
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(2)方程式中的a大于0(填“大于”“小于”或“等于”).
(3)700℃上述反应达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有BC(填序号)
A.缩小反应器体积 B.通入CO2 C.升高温度到900℃D.使用合适的催化剂.
7.进行化学实验时应强化安全意识.下列做法正确的是( )
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 做蒸馏实验时,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 |
8.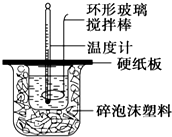 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
(1)本实验中用稍过量的NaOH的原因是保证盐酸完全被中和.在大小烧杯中填充泡沫塑料的作用是保温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见下表).
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容为:c=4.18×10-3kJ/(g•℃),则写出该反应的热化学方程式H+(aq)+OH-(aq)=H2O(l)△H=-56.0kJ/mol(△H值保留到小数点后1位).
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的△H偏大(填“偏大”、“偏小”或“不变”),其原因是醋酸是弱酸,反应时需要吸收热量用于醋酸的电离,所以,测得的中和反应的反应热数值会偏小,该反应为放热反应,△H则偏大.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)本实验中用稍过量的NaOH的原因是保证盐酸完全被中和.在大小烧杯中填充泡沫塑料的作用是保温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见下表).
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的△H偏大(填“偏大”、“偏小”或“不变”),其原因是醋酸是弱酸,反应时需要吸收热量用于醋酸的电离,所以,测得的中和反应的反应热数值会偏小,该反应为放热反应,△H则偏大.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
 .
.