题目内容
18. A、B、C为短周期元素,在周期表中所处的位置如图所示.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.
B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素的名称分别为氮、硫、氟;
(2)B位于元素周期表中第三周期,第VIA族;
(3)C的原子结构示意图为
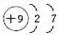 ,C的单质与水反应的化学方程式为2F2+2H2O=4HF+O2;
,C的单质与水反应的化学方程式为2F2+2H2O=4HF+O2;(4)比较B、C的原子半径;B>C,写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式2NH3+H2SO4=(NH4)2SO4.
分析 A、B、C为短周期元素,根据元素在周期表中位置知,A和C位于第二周期、B位于第三周期,设B原子序数为x,则A原子序数为x-9、C原子序数为x-7,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等,则x-9+x-7=x,则x=16,所以B是S元素,则A是N元素、C是F元素,以此解答该题.
解答 解:A、B、C为短周期元素,根据元素在周期表中位置知,A和C位于第二周期、B位于第三周期,设B原子序数为x,则A原子序数为x-9、C原子序数为x-7,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等,则x-9+x-7=x,则x=16,所以B是S元素,则A是N元素、C是F元素,
(1)通过以上分析知,A、B、C分别是氮、硫、氟元素,
故答案为:氮;硫;氟;
(2)B是S元素,S原子核外有3个电子层、最外层电子数是6,所以S元素位于第三周期第VIA族,
故答案为:三;ⅥA;
(3)C的原子序数为9,原子核外有2个电子城,最外层电子数为7,原子结构示意图为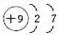 ;氟气与水反应生成氧气和HF,其反应的化学方程式为:2F2+2H2O=4HF+O2;
;氟气与水反应生成氧气和HF,其反应的化学方程式为:2F2+2H2O=4HF+O2;
故答案为: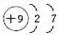 ;2F2+2H2O=4HF+O2;
;2F2+2H2O=4HF+O2;
(4)电子层数越大,原子半径越大,则原子半径:S>F;A的气态氢化物为NH3,B的最高价氧化物对应水化物为H2SO4,反应的化学方程式为2NH3+H2SO4=(NH4)2SO4,
故答案为:>;2NH3+H2SO4=(NH4)2SO4.
点评 本题考查元素的位置结构性质的相互关系及应用,题目难度不大,注意根据元素所在周期表中的位置和质子数的关系推断元素的种类,把握元素周期律的相似性和递变性的规律

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
13.如表是部分短周期元素的原子半径及主要化合价
①L元素的名称是镁,R元素的名称是硫.
②能与T元素组成的化合物具有两性的是BeO、Al2O3(写化学式).
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
②能与T元素组成的化合物具有两性的是BeO、Al2O3(写化学式).
10.我国钨资源矿产丰富.由黑钨矿提取钨发生的反应之一为:3H2+WO3$\frac{\underline{\;高温\;}}{\;}$W+3H2O.其基本反应类型是( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
7.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在氧气中的燃烧反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |

 石油中溶有一种碳氢化合物-金刚烷.金刚烷 是一种环状烃,它的结构高度对称.下图表示金刚烷,图中数字是碳原子编号.碳原子用小黑点表示,氢原子均省略,一条短线表示共用一对电子.
石油中溶有一种碳氢化合物-金刚烷.金刚烷 是一种环状烃,它的结构高度对称.下图表示金刚烷,图中数字是碳原子编号.碳原子用小黑点表示,氢原子均省略,一条短线表示共用一对电子.