题目内容
12.(1)现有m g某气体A2,它的摩尔质量为M g•mol-1.若阿伏加德罗常数用NA表示,则:①该气体的物质的量为$\frac{m}{M}$_mol.
②该气体所含原子总数为$\frac{2m{N}_{A}}{M}$个.
(2)已知反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
①该反应中N(填元素符号)被还原,还原剂是Cu(填化学式).
②在该反应中,若有9.03×1023个电子发生转移,在标准状况下,可生成标况下NO的体积为11.2L.
分析 (1)①根据n=$\frac{m}{M}$计算气体的物质的量;
②根据N=nNA计算分子数目,原子数目为分子2倍;
(2)①元素化合价降低发生还原反应,所含元素化合价升高的反应物为还原剂;
②根据n=$\frac{N}{{N}_{A}}$计算电子物质的量,根据电子转移守恒计算NO的物质的量,再根据V=nVm计算NO的体积.
解答 解:(1)①气体A2的摩尔质量为Mg/mol,mg气体A2的物质的量=$\frac{mg}{Mg/mol}$=$\frac{m}{M}$mol,故答案为:$\frac{m}{M}$;
②该气体所含原子总数为:$\frac{m}{M}$mol×NAmol-1×2=$\frac{2m{N}_{A}}{M}$,故答案为:$\frac{2m{N}_{A}}{M}$;
(2)①反应在N元素化合价降低,发生还原反应,Cu元素化合价升高,Cu为还原剂,
故答案为:N;Cu;
②转移电子物质的量为$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1.5mol,根据电子转移守恒,则生成NO的物质的量为$\frac{1.5mol}{5-2}$=0.5mol,标况下NO的体积为0.5mol×22.4L/mol=11.2L,
故答案为:11.2L.
点评 本题考查物质的量有关计算、氧化还原反应,难度不大,有利于基础知识的巩固.

练习册系列答案
相关题目
2.下列物质中,既能使溴水褪色,又能产生沉淀的是( )
| A. | 丁烯 | B. | 乙醇 | C. | 苯酚 | D. | 乙酸 |
3. 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )
 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )| A. | 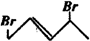 | B. | 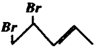 | C. |  | D. |  |
20.针对下面几种元素,完成以下各小题.
(1)C、N、O、Si四种元素电负性从小到大排列?硅<碳<氮<氧(填名称).
(2)Na、Mg、Al三种元素第一电离能从大到小排列?Mg>Al>Na(填符号).
(3)Al的电子排布式为?1s22s22p63s23p1?.N的外围电子排布式?2s22p3.
(4)S和O的氢化物相比,沸点较高的是?H2O?(填化学式),原因是?水分子之间存在氢键.
(5)干冰的电子式为? ,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出其逆反应的热化学方程式:?2NH3(g)?N2(g)+3H2(g)△H=+92kJ•mol-1.(其中N≡N键、N-H键、H-H的键能分别为946kJ•mol-1、391kJ•mol-1、436kJ•mol-1)
(7)26号元素的外围电子排布式为?3d64s2,其+3价阳离子的外围电子的轨道表示式为? .
.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)Na、Mg、Al三种元素第一电离能从大到小排列?Mg>Al>Na(填符号).
(3)Al的电子排布式为?1s22s22p63s23p1?.N的外围电子排布式?2s22p3.
(4)S和O的氢化物相比,沸点较高的是?H2O?(填化学式),原因是?水分子之间存在氢键.
(5)干冰的电子式为?
 ,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出其逆反应的热化学方程式:?2NH3(g)?N2(g)+3H2(g)△H=+92kJ•mol-1.(其中N≡N键、N-H键、H-H的键能分别为946kJ•mol-1、391kJ•mol-1、436kJ•mol-1)
(7)26号元素的外围电子排布式为?3d64s2,其+3价阳离子的外围电子的轨道表示式为?
 .
.
17.下列各主族元素的氢化物的沸点变化规律依次升高的是( )
| A. | HF、HCl、HBr、HI | B. | H2O、H2S、H2Se、H2Te | ||
| C. | NH3、PH3、AsH3、SbH3 | D. | CH4、SiH4、GeH4、SnH4 |
2.下列反应为吸热反应的是( )
| A. | 铝片与盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | NaOH与HCl反应 | D. | 食物的缓慢氧化 |
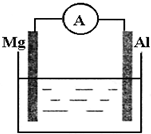 如图所示装置
如图所示装置