题目内容
16.设NA为阿伏伽德罗常数,下列叙述正确的是( )| A. | 常温常压下,100g 17%H2O2水溶液中含氧原子总数为NA | |
| B. | 常温常压下,2.8g N2气体分子中所含的共用电子对数目为0.3NA | |
| C. | 0.2mol/L的NaCl溶液中含有的Cl-数是0.2NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
分析 A、H2O2水溶液中除了双氧水外,水也含氧原子;
B、求出氮气的物质的量,然后根据1mol氮气中含3mol共用电子对来分析;
C、溶液体积不明确;
D、过氧化钠与水反应时,氧元素的价态由-1价变为0价.
解答 解:A、H2O2水溶液中除了双氧水外,水也含氧原子,故溶液中含有的氧原子的个数大于NA个,故A错误;
B、2.8g氮气的物质的量为0.1mol,而1mol氮气中含3mol共用电子对,故0.1mol氮气中含0.3mol共用电子对即0.3NA个,故B正确;
C、溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D、过氧化钠与水反应时,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
7.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,1.56g Na2O2含有的阴离子数为0.02NA | |
| B. | 标准状况下,22.4L SO3含有的分子数为NA | |
| C. | 0.1mol氯气参与反应,转移的电子数一定为0.2NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Clˉ个数为NA |
4.下列说法正确的是( )
| A. | 同温同压下,H2 (g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不相同 | |
| B. | 用pH试纸测定新制氯水的pH | |
| C. | 已知:①2H2(g)+O2(g)═2H2O (g)△H1 ②2H2(g)+O2 (g)═2H2O(1)△H2,则△H1<△H2 | |
| D. | 在中和滴定实验中,用待测NaOH溶液润洗锥形瓶,测定结果将偏高 |
11.下列关于浓硫酸的叙述正确的是( )
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 蓝色的胆矾晶体中加入浓硫酸,晶体会转化为白色固体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 常温下,浓硫酸不与铁、铝反应,所以可以用铁、铝制容器盛装浓硫酸 |
1.下列离子方程式中,正确的是( )
| A. | 将Cl2通入H2O中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NaOH溶液中加入Al粉:2Al+4OH-═2AlO2-+2H2O | |
| C. | 氯化亚铁溶液中加入新制氯水:Cl2+Fe2+═Fe3++2Cl- | |
| D. | NaHCO3溶液与盐酸的反应:HCO3-+H+═CO2↑+H2O |
8.下列说法不正确的是( )
| A. | 苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为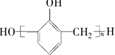 | |
| B. | (NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出,但沉淀原理不同 | |
| C. | 醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物 | |
| D. | 淀粉水解实验:淀粉溶液中加入稀硫酸加热水解得水解液,再加入NaOH溶液得中和液,后加入新制Cu(OH)2悬浊液加热后有红色沉淀.结论:淀粉已水解 |
5.下列关于化学反应限度的说法中正确的是( )
| A. | 当一个可逆反应达到平衡状态时,这就是这个反应在该条件下所能达到的限度 | |
| B. | 当一个可逆反应进行到平衡状态时,那么这个反应的所有物质的反应速率均相等 | |
| C. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再变化 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |
11.下列离子方程式改写成化学方程式正确的是( )
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-═H2O Ba(OH)2+H2SO4═BaSO4↓+2H2O |