题目内容
2.锂也是碱金属元素,下列关于锂及其化合物的推断肯定正确的是( )| A. | 锂单质可保存在煤油中 | |
| B. | 锂单质能与盐酸剧烈作用,并有气体产生 | |
| C. | LiOH的碱性比NaOH的碱性强 | |
| D. | Li+半径比Na+半径大 |
分析 A、锂是最轻的金属单质;
B、锂的金属活泼性仅次于钠;
C、金属性越强,所对应的最高价氧化物的水化物的碱性越强;
D、电子层数越多,原子半径越大.
解答 解:A、锂是最轻的金属单质,密度比煤油小,故不能保存在煤油中,要保存在石蜡油中,故A错误;
B、锂的金属活泼性仅次于钠,和盐酸剧烈反应生成LiCl和氢气,故B正确;
C、金属性越强,所对应的最高价氧化物的水化物的碱性越强,由于金属性Na强于Li,故NaOH的碱性强于LiOH,故C错误;
D、电子层数越多,原子半径越大,Li+的核外有1个电子层,而Na+的核外有2个电子层,故Na+的半径更大,故D错误.
故选B.
点评 本题考查了碱金属单质性质的相似性和递变性,应注意的是锂不能保存在煤油中,要保存在石蜡油中.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列反应可设计为化学电源的是( )
| A. | 2NH4Cl+Ba(OH)2•10H2O═BaCl2+2NH3↑+12H2O△H>0 | |
| B. | Fe3++3SCN-?Fe(SCN)3 △H<0 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0 | |
| D. | CaO+H2O═Ca(OH)2 △H<0 |
13.向AlCl3溶液中逐滴加入NaOH溶液至过量,反应中可以观察到的现象是( )
| A. | 产生白色沉淀,继而沉淀溶解 | B. | 只放出气体 | ||
| C. | 生成白色沉淀,且不消失 | D. | 既生成白色沉淀又放出气体 |
10.为了使FeSO4氧化成Fe2(SO4)3而又不引入杂质,应向悬浊液中加入( )
| A. | Cl2 | B. | HNO3 | C. | H2O2 | D. | Na2O2 |
7.相同物质的量的N2和CO两者相比较,下列说法不正确的是( )
| A. | 所占的体积一定相等 | B. | 所含原子总数相等 | ||
| C. | 所含电子总数相等 | D. | 所含分子数相等 |
14.已知:2NaAlO2+3H2O+CO2→2Al(OH)3↓+Na2CO3.向含2molNaOH、1mol Ba(OH)2、2mol NaAlO2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系正确的是( )
| 选项 | A | B | C | D |
| n(CO2)mol | 2 | 3 | 4 | 6 |
| n(沉淀) mol | 1 | 2 | 3 | 3 |
| A. | A | B. | B | C. | C | D. | D |
11.下列化合物中,不能由两种单质直接化合制得的是( )
| A. | FeS | B. | FeCl3 | C. | Fe3O4 | D. | FeCl2 |
11.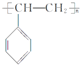 生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )
生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )
 生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )
生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )| A. | 聚苯乙烯能使溴水褪色 | |
| B. | 聚苯乙烯是一种天然高分子化合物 | |
| C. | 聚苯乙烯可由苯乙烯通过化合反应制得 | |
| D. | 聚苯乙烯单体的分子式为C8H8 |