题目内容
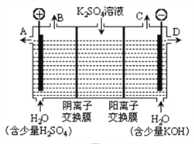
【题目】右图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极。则下列有关的判断不正确的是( )

A、d为负极,发生氧化反应
B、c为锌片,电池工作时,溶液中SO42-向c移动
C、电池工作的过程中,d电极上产生大量的气泡
D、电池工作的过程中,溶液中SO42-浓度基本不变
【答案】A
【解析】
试题分析:据图象知,c是负极、d是正极,Zn易失电子作负极、Cu作正极,所以c是Zn、d是Cu,负极反应式为 Zn﹣2e﹣=Zn2+、正极反应式为2H++2e﹣=H2↑,A.d是正极,正极上得电子发生还原反应,A错误;B.c为锌片,放电时,硫酸根离子向负极c移动,B正确;C.放电时,正极d上反应式为2H++2e﹣=H2↑,所以d电极上产生大量气泡,C正确;D.放电时,硫酸根离子不反应,所以溶液中SO42﹣浓度基本不变,D正确;故选A.

 阅读快车系列答案
阅读快车系列答案【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号)。
A.使用催化剂 B.适当提高氧气的浓度 C.适当提高反应的温度
(2)下图能正确表示该反应中能量变化的是________(填序号)。
A. 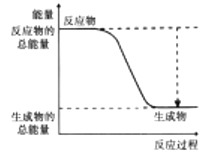 B.
B. 
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能 | 436 KJ·mol-1 | 496 KJ·mol-1 | 463 KJ·mol-1 |
请填写下表:_______________
化学键 | 填“吸收热量”或“放出热量” | 能量变化(KJ) |
拆开2molH2和1molO2中的化学键 | ①_________________ | ② KJ |
形成4molH-O键 | ③ | ④ KJ |
总能量变化 | ⑤ | ⑥ KJ |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________极发生________(“氧化”或“还原”)反应。
。其中,氢气在________极发生________(“氧化”或“还原”)反应。