题目内容
9.在55℃时,下列说法正确的是( )| A. | 向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变 | |
| B. | pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L | |
| C. | 饱和氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) | |
| D. | 0.1mol/L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
分析 A.NaHSO4=Na++H++SO42-,电离出H+的抑制了水的电离;
B.在55℃时”,水的离子积不是1×10-14;
C.饱和氯水中,溶解进入水中的氯气并没有全部和水反应;
D.强酸弱碱盐,显酸性,故c(H+)>c(OH-),根据(NH4)2SO4=2NH4++SO42-,水解在这里是微弱的;
解答 解:A.NaHSO4=Na++H++SO42-,电离出H+的抑制了水的电离,c(H+)增大,Kw不变,故A错误;
B.审题“在55℃时”,水的离子积不是1×10-14,计算所得的c(OH-)不是1×10-6mol/L,故B错误;
C.饱和氯水中,溶解进入水中的氯气并没有全部和水反应,此项中的关系式不对,故C错误;
D.强酸弱碱盐,显酸性,故c(H+)>c(OH-),根据(NH4)2SO4=2NH4++SO42-,水解在这里是微弱的,所以c(NH4+)>c(SO42-),而c(SO42-)>c(H+),0.1mol/L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故D正确.
故选D.
点评 本题考查了水的电离及影响因素、PH值的计算、盐类的水解及离子浓度的大小、氯水中的离子成分及浓度的大小,掌握基础是解题关键,题目难度中等.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
19.需经过称量、溶解、转移、定容等操作.下列图示对应的操作规范的是( )
| A. |  称量 | B. |  溶解 | C. |  转移 | D. |  定容 |
20.有甲、乙两种溶液,甲溶液的pH是乙溶液pH的2倍,则甲溶液中c(H+)与乙溶液中c(H+)的关系是( )
| A. | 2:1 | B. | 100:1 | C. | 1:100 | D. | 无法确定 |
17.聚丙烯酸酯类涂料是目前市场上流行的墙面涂料之一,它具有弹性好、不易老化、耐擦洗、色泽亮丽等优点.聚丙烯酸酯的结构简式为 它属于( )
它属于( )
①无机化合物 ②有机化合物 ③高分子化合物 ④小分子化合物 ⑤混合物 ⑥共价化合物.
 它属于( )
它属于( )①无机化合物 ②有机化合物 ③高分子化合物 ④小分子化合物 ⑤混合物 ⑥共价化合物.
| A. | ①③④ | B. | ①③⑤ | C. | ②③⑤⑥ | D. | ②③④ |
1.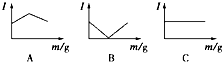 在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.
在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.
以下4个导电性实验,其中与A图B图C图对应一致的选项是( )
①Ba(OH)2溶液中滴入H2SO4溶液至过量②醋酸溶液中滴入NH3•H2O至过量
③澄清石灰水中通入CO2至过量④NH4Cl溶液中逐渐加入适量NaOH固体
 在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.
在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.以下4个导电性实验,其中与A图B图C图对应一致的选项是( )
①Ba(OH)2溶液中滴入H2SO4溶液至过量②醋酸溶液中滴入NH3•H2O至过量
③澄清石灰水中通入CO2至过量④NH4Cl溶液中逐渐加入适量NaOH固体
| A | B | C | |
| A | ① | ② | ③ |
| B | ④ | ②③ | ① |
| C | ③ | ①② | ④ |
| D | ② | ①③ | ④ |
| A. | A | B. | B | C. | C | D. | D |
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42- | |
| B. | 在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ | |
| C. | 在含有大量Fe3+的溶液中:Cu2+、Cl-、NO3-、S2- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |




 A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题: 已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.
已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.