题目内容
15.把黑色固体A加热至红热,投入到一种无色溶液B中,产生由两种气体组成的混合气体X,将X作如下图所示的实验: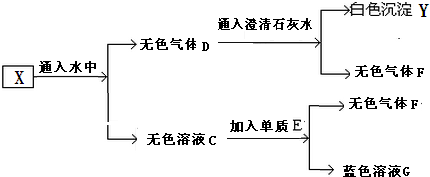
(1)写出有关物质的化学式:X为NO2、CO2,B为HNO3(浓),D为NO、CO2,F为NO,
(2)写出:A与溶液B反应的化学反应方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2OX通入水中发生反应的化学反应方程式为3NO2+H2O=2HNO3+NO
溶液C与单质E反应的离子反应方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
分析 无色气体D通入澄清石灰水生成白色沉淀,该沉淀应为CaCO3,说明C中含有CO2;无色稀溶液C与单质E反应生成蓝色溶液,该溶液应含有Cu2+,则说明E为Cu;无色稀溶液C具有强氧化性,应为稀HNO3溶液,生成气体F为NO,则说明混合气体X应为CO2和NO2的混合物,C为CO2和NO的混合物,则A为C,B为HNO3(浓),结合物质的性质解答该题.
解答 解:无色气体D通入澄清石灰水生成白色沉淀,该沉淀应为CaCO3,说明C中含有CO2;无色稀溶液C与单质E反应生成蓝色溶液,该溶液应含有Cu2+,则说明E为Cu;无色稀溶液C具有强氧化性,应为稀HNO3溶液,生成气体F为NO,则说明混合气体X应为CO2和NO2的混合物,C为CO2和NO的混合物,则A为C,B为HNO3(浓),
(1)根据分析可知:X为 NO2、CO2,B为HNO3(浓),D为NO、CO2,F为NO,
故答案为:NO2、CO2;HNO3(浓);NO、CO2;NO;
(2)A与溶液B反应为碳与浓硝酸的反应,反应的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;
X为NO2,NO2通入水中发生反应的化学反应方程式为:3NO2+H2O=2HNO3+NO;
溶液C与单质E反应的离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;3NO2+H2O=2HNO3+NO;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题考查无机物推断,题目难度中等,明确常见元素单质及其化合物性质为解答关键,注意抓住突破口,如“蓝色溶液G”、澄清石灰水变浑浊等,试题培养了学生的逻辑推理能力.

 阅读快车系列答案
阅读快车系列答案| A. | 食盐水蒸发结晶,蒸发皿中出现大量晶体时停止加热,利用余热使溶液蒸干 | |
| B. | 金属钠着火,立即用沙土扑灭 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 实验室制取蒸馏水的装置中,冷水从冷凝管的上口进,下口出 |
| 选项 | Na2B2O7 | CaF2 | H3BO3 | NH3 |
| A | 原子晶体 | 金属晶体 | 原子晶体 | 分子晶体 |
| B | 离子晶体 | 分子晶体 | 离子晶体 | 分子晶体 |
| C | 离子晶体 | 离子晶体 | 分子晶体 | 分子晶体 |
| D | 分子晶体 | 离子晶体 | 分子晶体 | 离子晶体 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氢氧燃料电池的正极反应式为H2+2OH--2e-═2H2O | |
| B. | 用铂电极电解硫酸铜溶液的阳极反应式为4OH--4e-═O2↑+2H2O | |
| C. | 表示醋酸与NaOH的稀溶液反应的中和热的化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ.mol-1 | |
| D. | NaHSO3溶于水时水解的离子方程式为HSO3-+H2O?SO32-+H3O+ |
| A. | 0.5 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.2 mol•L-1 |
| A. | Si可用于制造半导体材料 | |
| B. | 二氧化硫可广泛用于食品的增白 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 84消毒液的有效成分是NaClO,可用于环境的消毒杀菌 |
| A. | a>b>c | B. | c>a>b | C. | b>a>c | D. | a>c>b |
| A. | CuSO4溶液 | B. | Na2CO3溶液 | C. | Fe(OH)3胶体 | D. | Ba(OH)2溶液 |