题目内容
在一定条件下,向一个容积不变的容器中,加入3molSO2和2molO2及固体催化剂,发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol.平衡时容器内气体压强为起始时的90%.
(1)加入3molSO2和2molO2发生反应,达到平衡时,放出的热量为 .
(2)保持温度不变,在相同的容器中,将起始物质的物质的量改为a molSO2、b molO2、c molSO3(g)(C>0),欲使平衡时SO3的体积分数为2/9,O2的体积分数为1/3,则:
①达到平衡时,(1)与(2)放出的热量 (填序号).
A、相等 B、前者小于后者 C、前者大于后者 D、无法确定
②a、b、c必需满足的关系是(一个用a、c表示,另一个用b、c表示) 、 .
(1)加入3molSO2和2molO2发生反应,达到平衡时,放出的热量为
(2)保持温度不变,在相同的容器中,将起始物质的物质的量改为a molSO2、b molO2、c molSO3(g)(C>0),欲使平衡时SO3的体积分数为2/9,O2的体积分数为1/3,则:
①达到平衡时,(1)与(2)放出的热量
A、相等 B、前者小于后者 C、前者大于后者 D、无法确定
②a、b、c必需满足的关系是(一个用a、c表示,另一个用b、c表示)
考点:反应热和焓变,化学平衡的影响因素,等效平衡
专题:化学平衡专题
分析:(1)根据压强之比等于物质的量之比计算平衡时混合气体总的物质的量,再利用差量法计算参加反应的二氧化硫的物质的量,结合热化学方程式计算放出的热量;
(2)根据(1)计算可知,原平衡时SO3的体积分数为
=
,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,平衡时SO3的体积分数为
,则与原平衡为等效平衡,但c>0,(2)参加反应的物质不如(1)多,据此判断;
(3)假定体积为VL,利用三段式计算原平衡时各组分的物质的量,进而计算平衡常数,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,计算此时的浓度商,与平衡常数比较判断反应进行方向.
(2)根据(1)计算可知,原平衡时SO3的体积分数为
| 1mol |
| 4.5mol |
| 2 |
| 9 |
| 2 |
| 9 |
(3)假定体积为VL,利用三段式计算原平衡时各组分的物质的量,进而计算平衡常数,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,计算此时的浓度商,与平衡常数比较判断反应进行方向.
解答:
解:(1)由题意气体压强为起使时的90%,则反应后总的物质的量为起使时的90%,平衡时总物质的量为(3mol+2mol)×90%=4.5mol,则平衡时各组成物质的量变化为:
2SO2+O2?2SO3 物质的量减少△n
2 1 2 1
1mol 0.5mol 1mol (3mol+2mol)-4.5mol=0.5mol
此时放出的热量为196.6KJ×
=98.3KJ,
故答案为:98.3;
(2)原平衡时SO3的体积分数为
=
,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,平衡时SO3的体积分数为
,则与原平衡为等效平衡,c>0,说明(2)比(1)反应的少,放热就少,故答案为:C;
(3)原平衡时SO3的体积分数为
=
,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,平衡时SO3的体积分数为
,则与原平衡为等效平衡,则a+c=3 b+0.5c=2,故答案为:a+c=3; b+0.5c=2.
2SO2+O2?2SO3 物质的量减少△n
2 1 2 1
1mol 0.5mol 1mol (3mol+2mol)-4.5mol=0.5mol
此时放出的热量为196.6KJ×
| 0.5mol |
| 1mol |
故答案为:98.3;
(2)原平衡时SO3的体积分数为
| 1mol |
| 4.5mol |
| 2 |
| 9 |
| 2 |
| 9 |
(3)原平衡时SO3的体积分数为
| 1mol |
| 4.5mol |
| 2 |
| 9 |
| 2 |
| 9 |
点评:本题为化学平衡和反应热综合试题,试题难度较大,注意等效平衡的原理的运用.

练习册系列答案
相关题目
下列化学用语或模型正确的是( )
A、氯化氢的电子式: |
| B、8个中子的碳原子:12C |
C、硫离子结构示意图: |
D、CH4分子的比例模型: |
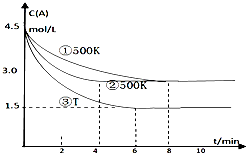 某反应2A(g)?2B(g)+C(g)(吸热反应)在三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示.
某反应2A(g)?2B(g)+C(g)(吸热反应)在三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示. 密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图.则:
密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图.则: 过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在1L固定体积的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示.
过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在1L固定体积的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示.