题目内容
9.化学与生活密切相关,下列有关说法正确的是( )| A. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是有机高分子材料 |
分析 A.维生素C又称为抗坏血酸,在人体内有重要功能,起抗氧化作用;
B.油脂不是高分子化合物;
C.煤经气化和液化为化学变化;
D.光导纤维的主要成分为二氧化硅.
解答 解:A.维生素C又称为抗坏血酸,缺乏维生素C会导致坏血病,维生素C具有还原性,在人体内起抗氧化作用,故A正确;
B.高分子化合物的相对分子质量在10000以上,油脂不是高分子化合物,故B错误;
C.煤经气化和液化分别生成CO、氢气、甲醇,为化学变化,故C错误;
D.光导纤维的主要成分为二氧化硅,为无机物,故D错误.
故选A.
点评 本题综合考查物质的性质和用途,为高考常见题型,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学生学习的积极性.

练习册系列答案
相关题目
20.为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)
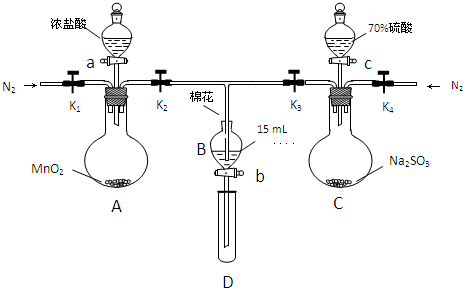
实验过程:
Ⅰ.打开弹簧夹K1-K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程IV,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的氧气
(2)棉花中浸润的溶液为氢氧化钠溶液
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O
(4)用70%的硫酸支取SO2,反应速率比用98%的硫酸块,原因是70%的硫酸中的H+的浓度比98%的硫酸中的H+的浓度大
(5)过程Ⅳ中检验B溶液中是否含有硫酸根的操作是取少量B溶液于试管中,加入足量的稀盐酸酸化,在滴加几滴氯化钡溶液,若有白色沉淀生成,证明溶液B中有硫酸根
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化Cl2>Fe3+>SO2的是乙丙
(7)进行实验过程Ⅴ时,B中的溶液颜色由黄色变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色.
查阅资料:Fe2+(aq)+SO32-(aq)?FeSO3(s)
提出假设:FeCl3和SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合颜色.
某同学设计如下实验,证实该假设的成立:
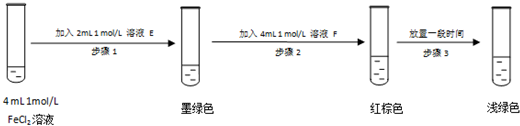
溶液E和F分别是Na2SO3溶液、FeCl3溶液
请用化学平衡原理解释步骤3红棕色溶液变为浅绿色的原因反应2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,促使Fe3++3H2O Fe(OH)3+3H+和SO32-+H2O
Fe(OH)3+3H+和SO32-+H2O  HSO32-+OH-逆向进行,溶液变为浅绿色.
HSO32-+OH-逆向进行,溶液变为浅绿色.

实验过程:
Ⅰ.打开弹簧夹K1-K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程IV,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的氧气
(2)棉花中浸润的溶液为氢氧化钠溶液
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O
(4)用70%的硫酸支取SO2,反应速率比用98%的硫酸块,原因是70%的硫酸中的H+的浓度比98%的硫酸中的H+的浓度大
(5)过程Ⅳ中检验B溶液中是否含有硫酸根的操作是取少量B溶液于试管中,加入足量的稀盐酸酸化,在滴加几滴氯化钡溶液,若有白色沉淀生成,证明溶液B中有硫酸根
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化Cl2>Fe3+>SO2的是乙丙
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查阅资料:Fe2+(aq)+SO32-(aq)?FeSO3(s)
提出假设:FeCl3和SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合颜色.
某同学设计如下实验,证实该假设的成立:

溶液E和F分别是Na2SO3溶液、FeCl3溶液
请用化学平衡原理解释步骤3红棕色溶液变为浅绿色的原因反应2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,促使Fe3++3H2O
 Fe(OH)3+3H+和SO32-+H2O
Fe(OH)3+3H+和SO32-+H2O  HSO32-+OH-逆向进行,溶液变为浅绿色.
HSO32-+OH-逆向进行,溶液变为浅绿色.
4.下列关于某些离子的检验说法正确的是( )
| A. | 向某溶液中加稀盐酸,将产生的无色气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有CO32-或HCO3- | |
| B. | 向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定有SO42- | |
| C. | 向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则原溶液中存在NH4+ | |
| D. | 分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用NaOH溶液不能一次性鉴别出来 |
14.下列实验能获得成功的是( )
| A. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入AgNO3溶液检验Cl- | |
| B. | 将淀粉在酸性条件下水解后直接加入银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 除去苯中的苯酚的方法是:加溴水,振荡,过滤除去沉淀 | |
| D. | 除去混入CH3CH2OH中的蚁酸HCOOH:加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 |
1.下列说法正确的是( )
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物CaCl2中,两个氯离子之间也存在离子键 | |
| C. | 分子中只有共价键的化合物一定是共价化合物 | |
| D. | 不同元素组成的多原子分子中的化学键一定为极性键 |
18.下列关于二氧化硅的说法中,错误的是( )
| A. | 二氧化硅和二氧化碳在物理性质上有很大的差别 | |
| B. | 二氧化硅分子由一个硅原子和两个氧原子构成 | |
| C. | 工业上用二氧化硅制粗硅 | |
| D. | 二氧化硅既能与氢氟酸反应,又能与烧碱反应,但它不是两性氧化物 |
9.已知AB2+D2═B2+AD2,2AB2+3D2═2AD3+2B2,AC2+B2═AB2+C2(反应中涉及的化合物均属于离子化合物,阴离子均显-1价),下列有关说法中不正确的是( )
| A. | 氧化性强弱:D2>B2 | B. | D2能氧化C- | ||
| C. | 还原性强弱:A2+>B- | D. | 第二个反应中A3+是氧化产物 |
 .
.