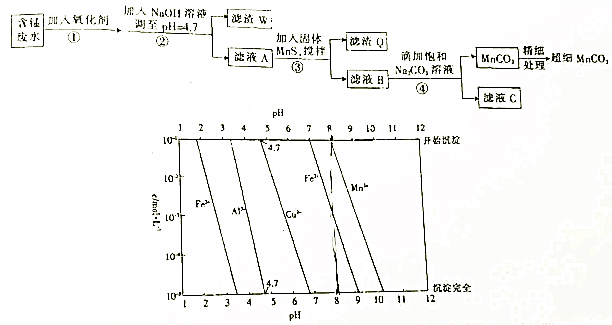
题目内容
5.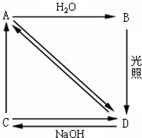 常温下,A是双原子分子气态单质,其密度为3.17g•L-1,B、C、D都是含A元素的化合物,相互之间存在图所示的转化关系.
常温下,A是双原子分子气态单质,其密度为3.17g•L-1,B、C、D都是含A元素的化合物,相互之间存在图所示的转化关系.(1)A的摩尔质量为71g/mol.
(2)实验室一般选择MnO2(填化学式)与D的浓溶液在加热条件下制取A的气态单质.
(3)C→A可通过氯碱工业实现,反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(4)B光照条件下反应的化学方程式为2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
分析 常温下,A是双原子分子气态单质,其密度为3.17g/L(标准状况下),则A的摩尔质量=3.17g/L×22.4L/mol=71g/mol,则A的相对原子质量是35.5,则A是Cl2,根据转化关系知C是NaCl、D是HCl,B光照生成D,则B是HClO,据此分析解答.
解答 解:常温下,A是双原子分子气态单质,其密度为3.17g/L(标准状况下),则A的摩尔质量=3.17g/L×22.4L/mol=71g/mol,则A的相对原子质量是35.5,则A是Cl2,根据转化关系知C是NaCl、D是HCl,B光照生成D,则B是HClO,
(1)通过以上分析知,A的摩尔质量为71g/mol,故答案为:71g/mol;
(2)D是HCl,A是Cl2,实验室用MnO2和浓盐酸制取氯气,所以实验室一般选择MnO2与D的浓溶液在加热条件下制取A的气态单质,故答案为:MnO2;
(3)C是NaCl,A是Cl2,电解饱和氯化钠制取氯气,反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(4)B是HClO,B光照条件下分解生成HCl和氧气,该反应的化学方程式为2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,故答案为:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
点评 本题考查无机物推断,为高频考点,明确Cl元素及其化合物之间转化为,明确物质性质及物质之间发生的反应是解本题关键,题目难度不大.

练习册系列答案
相关题目
16.下列物质能用来干燥CO2气体的是( )
| A. | 氢氧化钠 | B. | 碱石灰 | C. | 氧化钙 | D. | 浓H2SO4 |
13.如图是某加碘食盐包装袋上的部分图表文字.由此你得到的信息和作出的推测是( )
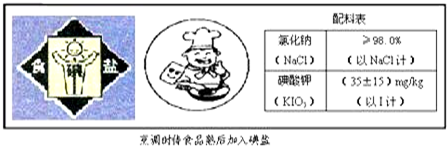

| A. | 可以用酒精从该碘盐配制的溶液中萃取KIO3 | |
| B. | “烹调时待食品熟后加入碘盐”的原因可能是碘酸钾受热易分解 | |
| C. | 1 kg此食盐中含碘酸钾(35±15)mg | |
| D. | 食用加碘盐的目的是预防龋齿 |
20.A、B、C是三种金属,根据下列①、②两个实验:①将A与B浸在稀硫酸中用导线相连,B上有气泡逸出,A逐渐溶解;②电解物质的量浓度相同的B2+、C2+盐溶液时,阴极上先析出C(使用惰性电极).确定它们的还原性强弱顺序为( )
| A. | A>B>C | B. | B>C>A | C. | C>A>B | D. | B>A>C |
10.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 向某未知溶液中滴加几滴稀溴水 | 没有生成白色沉淀 | 溶液中一定不含苯酚 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | 分别加热Na2CO3和NaHCO3固体 试管内壁都有水珠 两种物质均受热分解 | |
| B. | 向某未知溶液中滴加几滴稀溴水 没有生成白色沉淀 溶液中一定不含苯酚 | |
| C. | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 加入淀粉后溶液变成蓝色 氧化性:Cl2>I2 | |
| D. | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 加入H2O2后溶液变成血红色 Fe2+既有氧化性又有还原性 |
17.下列有关化学用语或名称,表达错误的是( )
| A. | 丙烷分子的球棍模型图: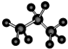 | B. | TNT的分子式:C7H5N3O6 | ||
| C. | 乙烯分子的比例模型: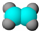 | D. | 苯乙醛的结构简式: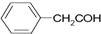 |
14.已知下列物质的氧化性强弱的顺序为Cl2>FeCl3>I2>H2SO4,判断下列化学反应不能发生的是( )
| A. | I2+SO2+2H2O═H2SO4+2HI | B. | 2FeCl2+Cl2═2FeCl3 | ||
| C. | 2FeCl3+2HI═2FeCl2+2HCl+I2 | D. | FeCl2+I2═FeI2+Cl2 |