题目内容
5.软锰矿(主要成份为MnO2)可用于制备锰及其化合物,如图为现代冶炼软锰矿制化学纯MnO2的工艺流程图.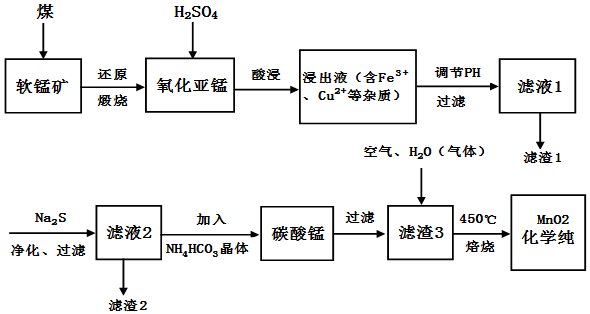
(1)软锰矿还能在C6H12O6和50%的H2SO4条件下还原浸出得到MnSO4,写出该反应的离子方程式:12MnO2+24H++C6H12O6=12Mn2++6CO2+18H2O,同上述流程相比此法的优点是能耗低、操作更简便、转化率高.
(2)写出能提高氧化亚锰(MnO)浸出率的措施:适当升高反应体系温度,及适当增大H2SO4浓度.
(3)滤渣1和滤渣2分别为Fe(OH)3、CuS(填化学式).
(4)写出滤液2加入NH4HCO3晶体制碳酸锰的化学方程式MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+CO2↑+H2O;写出由滤渣3制化学纯MnO2的化学方程式2MnCO3+O2$\frac{\underline{\;450℃\;}}{\;}$MnO2+2CO2.
(5)已知,t℃时Ksp[Mn(OH)2]=10-12.7,Ksp(MnCO3)=10-10.2,若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO${\;}_{3}^{2-}$(aq),t℃时,计算该反应的平衡常数K=102.5.(填数值)
(6)剩余的MnCO3及低价氧化亚锰,经H2SO4溶出,氯酸钠重质化,再经洗涤,烘干也可制得化学纯MnO2(过程中会有黄绿色气体放出),写出该反应的离子方程式5Mn2++2ClO3-+4H2O=5MnO2+Cl2+8H+.
分析 软锰矿(主要成份为MnO2)与煤还原煅烧得到氧化亚锰,加入稀硫酸浸出得到硫酸锰溶液,溶液中还含有Fe3+、Cu2+等杂质,调节溶液的pH,将 Fe3+以Fe(OH)3沉淀下来,向滤液中加入硫化钠,可以将铜离子形成硫化物沉淀下来,再加入碳酸氢铵晶体,得到碳酸锰,碳酸锰与氧气混合高温焙烧生成MnO2,
(1)软锰矿与C6H12O6和50%的H2SO4条件下生成MnSO4,锰元素化合价降低,则碳元素化合价升高生成二氧化碳;该方法能耗低、操作更简便、转化率高;
(2)升高温度、适当增大酸的浓度可提高物质浸出率;
(3)根据分析滤渣1为Fe(OH)3;滤渣2为CuS;
(4)滤液2主要成分为硫酸锰,加入NH4HCO3晶体生成碳酸锰、硫酸铵、二氧化碳和水;碳酸锰高温下被氧气氧化为二氧化锰;
(5)反应MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq),平衡常数K=$\frac{c(C{{O}_{3}}^{2-})}{{c}^{2}(O{H}^{-})}$=$\frac{c(C{{O}_{3}}^{2-})}{{c}^{2}(O{H}^{-})}$$•\frac{c(M{n}^{2+})}{c(M{n}^{2+})}$=$\frac{Ksp(MnC{O}_{3})}{Ksp[Mn(OH)_{2}]}$,据此计算;
(6)锰离子在酸性条件下被氯酸根离子氧化为二氧化锰,氯酸根离子被还原为氯离子.
解答 解:(1)软锰矿与C6H12O6和50%的H2SO4条件下生成MnSO4,锰元素化合价降低,则碳元素化合价升高生成二氧化碳,反应为:12MnO2+24H++C6H12O6=12Mn2++6CO2+18H2O;该方法能耗低、操作更简便、转化率高;
故答案为:12MnO2+24H++C6H12O6=12Mn2++6CO2+18H2O;能耗低、操作更简便、转化率高;
(2)适当升高反应体系温度,及适当增大H2SO4浓度可提高氧化亚锰(MnO)浸出率;
故答案为:适当升高反应体系温度,及适当增大H2SO4浓度;
(3)浸出液含有Fe3+、Cu2+等杂质,调节溶液的pH,将 Fe3+以Fe(OH)3沉淀下来,向滤液中加入硫化钠,可以将铜离子形成硫化物沉淀下来,故滤渣1为Fe(OH)3;滤渣2为CuS;
故答案为:Fe(OH)3;CuS;
(4)滤液2主要成分为硫酸锰,加入NH4HCO3晶体生成碳酸锰、硫酸铵、二氧化碳和水,反应为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+CO2↑+H2O;碳酸锰高温下被氧气氧化为二氧化锰,反应为:2MnCO3+O2$\frac{\underline{\;450℃\;}}{\;}$MnO2+2CO2;
故答案为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+CO2↑+H2O;2MnCO3+O2$\frac{\underline{\;450℃\;}}{\;}$MnO2+2CO2;
(5)已知,t℃时Ksp[Mn(OH)2]=10-12.7,Ksp(MnCO3)=10-10.2,反应MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq),平衡常数K=$\frac{c(C{{O}_{3}}^{2-})}{{c}^{2}(O{H}^{-})}$=$\frac{c(C{{O}_{3}}^{2-})}{{c}^{2}(O{H}^{-})}$$•\frac{c(M{n}^{2+})}{c(M{n}^{2+})}$=$\frac{Ksp(MnC{O}_{3})}{Ksp[Mn(OH)_{2}]}$=$\frac{1{0}^{-10.2}}{1{0}^{-12.7}}$=102.5;
故答案为:102.5;
(6)锰离子在酸性条件下被氯酸根离子氧化为二氧化锰,氯酸根离子被还原为氯离子,离子方程式为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2+8H+;
故答案为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2+8H+.
点评 本题考查物质准备工艺流程,涉及物质分离和提纯和制备、难溶物的溶解平衡、离子方程式书写、氧化还原反应等知识点,侧重考查基本理论,难点是难溶物溶解平衡计算,题目难度中等.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
| A. | 制备H2时,为防止H2逸出,待刚刚出现气泡时就在气体发生器出气口点燃 | |
| B. | 取用化学药品时,应特别注意药品包装容器上的安全警示标志 | |
| C. | 凡是给玻璃仪器加热,都要垫石棉网,以防仪器炸裂 | |
| D. | 为更清楚地闻到化学药品的气味可使鼻子凑近药品 |
| A. | 向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-═CuS↓+H2S↑ | |
| B. | 向NH4Al(SO4)2溶液加入含两倍物质的量的Ba(OH)2溶液:Al3++2SO${\;}_{4}^{2-}$+4OH-+2Ba2+═2BaSO4↓+AlO${\;}_{2}^{-}$+2H2O | |
| C. | 向Na2S2O3溶液中通入足量的Cl2:S2O${\;}_{3}^{2-}$+2Cl2+3H2O═2SO${\;}_{3}^{2-}$+4Cl-+6H+ | |
| D. | 用石墨电极电解MgCl2溶液阴极电极反应:2H2O+2e-═H2↑+2OH- |
| A. | 用Al(OH)3治疗胃酸过多 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用金属铝进行铝热法炼铁 | D. | 用水玻璃制备硅胶和木材防火剂 |
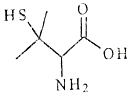
| A. | X的分子式为C5H10NO2S | |
| B. | X有2个手性碳原子 | |
| C. | X能发生加聚反应生成高分子化合物 | |
| D. | X既能与强酸反应,又能与强碱反应 |
 有机物与人们的衣、食、住、行及健康等有非常密切的关系,认知和研究有机物具有十分重要的作用.
有机物与人们的衣、食、住、行及健康等有非常密切的关系,认知和研究有机物具有十分重要的作用.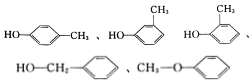 (任写一种).
(任写一种).
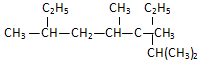 名称2,3,4,6-四甲基-3-乙基辛烷.
名称2,3,4,6-四甲基-3-乙基辛烷.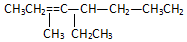 名称:2-甲基-3-乙基-1-戊烯.
名称:2-甲基-3-乙基-1-戊烯.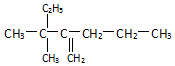 名称:3,3-二甲基-2-丙基-1-戊烯.
名称:3,3-二甲基-2-丙基-1-戊烯.