题目内容
(1)下列每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来.
①NaCl、KCl、NaClO、BaCl2 ; ②浊液、溶液、胶体、水 ;
(2)配制物质的量浓度为0.2mol/L的NaOH溶液500mL,填空并请回答下列问题:
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是 .
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线.
①NaCl、KCl、NaClO、BaCl2
(2)配制物质的量浓度为0.2mol/L的NaOH溶液500mL,填空并请回答下列问题:
| 应称量NaOH的质量/g | 已给仪器 | 除已给仪器外还需要的其他仪器 |
| 烧杯、托盘天平、药匙 |
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线.
考点:酸、碱、盐、氧化物的概念及其相互联系,分散系、胶体与溶液的概念及关系,溶液的配制
专题:实验题,物质的分类专题
分析:(1)①根据构成盐的元素分析;
②从混合物、纯净物的角度来分析;
(2)利用n=cv计算出氢氧化钠的物质的量,再根据m=nM计算所需氢氧化钠的质量;根据配制溶液的操作步骤选择所用仪器;
(3)根据公式c=
,可以根据影响n和V的因素来分析回答.
②从混合物、纯净物的角度来分析;
(2)利用n=cv计算出氢氧化钠的物质的量,再根据m=nM计算所需氢氧化钠的质量;根据配制溶液的操作步骤选择所用仪器;
(3)根据公式c=
| n |
| V |
解答:
解:(1)①NaCl、KCl、BaCl2为盐酸盐,NaClO为次氯酸盐,故答案为:NaClO;
②浊液、溶液、胶体都是混合物,水是纯净物,故答案为:水;
(2)依据物质的量的关系n=CV=0.2×0.5=0.1mol,m=nM=0.1mol×40g/mol=4.0g,实验中用到500mL容量瓶、胶头滴管、玻璃棒,
故答案为:4.0g;500mL容量瓶、胶头滴管、玻璃棒;
(3)A.氢氧化钠易潮解,称取的溶质偏小,浓度偏小,故A错误;
B.容量瓶最终需要加蒸馏水定容,无影响,故B错误;
C.未冷却,溶液体积偏小,浓度偏大,故C正确;
D.定容时仰视容量瓶刻度线,体积偏大,浓度偏小,故D错误.
故答案为:C.
②浊液、溶液、胶体都是混合物,水是纯净物,故答案为:水;
(2)依据物质的量的关系n=CV=0.2×0.5=0.1mol,m=nM=0.1mol×40g/mol=4.0g,实验中用到500mL容量瓶、胶头滴管、玻璃棒,
故答案为:4.0g;500mL容量瓶、胶头滴管、玻璃棒;
(3)A.氢氧化钠易潮解,称取的溶质偏小,浓度偏小,故A错误;
B.容量瓶最终需要加蒸馏水定容,无影响,故B错误;
C.未冷却,溶液体积偏小,浓度偏大,故C正确;
D.定容时仰视容量瓶刻度线,体积偏大,浓度偏小,故D错误.
故答案为:C.
点评:本题考查一定物质的量浓度溶液的稀释,注意容量瓶、量筒规格的选取方法,根据公式c=
判断反应的误差,为易错点.
| n |
| v |

练习册系列答案
相关题目
下列说法正确的是( )
| A、吸滤瓶内液面高度将达到支管口时,应拔掉吸滤瓶上的橡皮管,并从吸滤瓶支管口倒出溶液 |
| B、在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
| C、在“牙膏中某些主要成分的检验”实验中,在牙膏与蒸馏水搅拌、静置分离后的澄清溶液中加入少量的新制Cu(OH)2,当产生绛蓝色沉淀时,说明牙膏中含有甘油 |
| D、在盛有氯化钴溶液的试管中,加入一定量的浓盐酸,溶液的颜色由粉红色变为蓝色 |
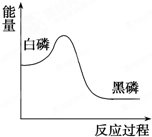 白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示.下列叙述中正确的是( )
白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示.下列叙述中正确的是( )| A、黑磷比白磷稳定 |
| B、黑磷与白磷互为同分异构体 |
| C、白磷转化为黑磷是氧化还原反应 |
| D、白磷转化为黑磷是吸热反应 |
 某研究性学习小组用电解CuSO4溶液的方法测定铜的相对原子质量(装置如图),实验中测得某电极的质量增重为m g,已知氧元素相对原子质量为16.请回答:
某研究性学习小组用电解CuSO4溶液的方法测定铜的相对原子质量(装置如图),实验中测得某电极的质量增重为m g,已知氧元素相对原子质量为16.请回答:
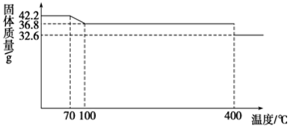 食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.42.2g K4[Fe(CN)6]?3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.42.2g K4[Fe(CN)6]?3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.