题目内容
2.10.6g某有机化合物A完全燃烧后,得到0.8molCO2气体和9.0g H2O,该有机化合物对氢气的相对密度是53.(1)求该有机物的相对分子质量;
(2)求该有机物的分子式;
(3)根据下列实验现象及结论,写出该有机物的结构简式.
①分子中含有苯环,
②它能使KMnO4酸性溶液褪色,
③它能发生硝化反应,当引入1个硝基时,只能得到1种硝基化合物.
分析 该有机化合物对氢气的相对密度是53,则相对分子质量为106,10.6g有机化合物A的物质的量为0.1mol,得到0.8molCO2气体和9.0g H2O,可知1mol有机物含有8molC原子,且n(H2O)=$\frac{9.0g}{18g/mol}$=0.5mol,n(H)=1mol,则1mol有机物含有10molH,且8×12+10=106,说明不含O元素,分子式为C8H10,以此解答该题.
解答 解:(1)该有机化合物对氢气的相对密度是53,则相对分子质量为106,
答:该有机物的相对分子质量为106;
(2)10.6g有机化合物A的物质的量为0.1mol,得到0.8molCO2气体和9.0g H2O,可知1mol有机物含有8molC原子,且n(H2O)=$\frac{9.0g}{18g/mol}$=0.5mol,n(H)=1mol,则1mol有机物含有10molH,且8×12+10=106,说明不含O元素,分子式为C8H10,
答:该有机物的分子式为C8H10;
(3)①分子中含有苯环,②它能使KMnO4酸性溶液褪色,则苯环上含有烃基,③它能发生硝化反应,当引入1个硝基时,只能得到1种硝基化合物,说明结构对称,应为 ,
,
答:该有机物的结构简式为 .
.
点评 本题考查有机物推断,为高频考点,侧重于学生的分析、计算能力的考查,注意把握有机物的结构与性质的关系,难度不大.

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
12.关于热化学方程式:2H2(g)+O2(g)=2H2O(1),H=-571.6kJ•mol-1,下列叙述正确的是( )
| A. | 2mol气态H2与1mol气态氧气完全燃烧生成2mol液态水时放出571.6 kJ的热量 | |
| B. | 1mol气态H2与0.5mol气态氧气完全燃烧生成1mol液态水时吸收285.8kJ的热量 | |
| C. | 2个氢分子完全燃烧生成液态水时放出571.6 kJ的热量 | |
| D. | 上述热化学方程式可表示为H2(g)+O2(g)=H2O(1),H=-285.8 kJ•mol-1 |
10.化学与生活、生产实际密切相关.下列有关说法不正确的是( )
| A. | 光导纤维应避免在强碱环境中使用 | |
| B. | 船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 利用碳酸酯聚合材料生产一次性饭盒,可以减少对环境产生的白色污染 | |
| D. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 |
17.钒是一种重要的合金元素,还用于催化剂和新型电池.从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如图1:

部分含钒化合物在水中的溶解性如表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO${\;}_{2}^{+}$+H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL0.1000 mol/L
H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.

部分含钒化合物在水中的溶解性如表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO${\;}_{2}^{+}$+H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL0.1000 mol/L
H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.
7.下列实验现象描述正确的是( )
| A. | 硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体 | |
| B. | 碳在空气中燃烧,发出白光,生成使澄清石灰水变浑浊的气体 | |
| C. | 红磷在空气中燃烧,产生大量白色烟雾 | |
| D. | 将分别装有氨水和酚酞溶液的两只烧杯靠近,氨水先变红 |
14.分子式为C10H14O,苯环上只有一个取代基且属于醇的同分异构体有( )
| A. | 10 | B. | 12 | C. | 11 | D. | 14 |
5.在K2Cr2O7溶液中存在平衡:Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)
(橙色) (黄色)
下列说法正确的是( )
(橙色) (黄色)
下列说法正确的是( )
| A. | 滴加硫酸酸化的FeSO4溶液,平衡不移动 | |
| B. | 溶液颜色保持不变时,该反应达到平衡状态 | |
| C. | 滴加6 mol/L NaOH溶液,溶液颜色变深 | |
| D. | 平衡常数表达式为K=$\frac{2c(Cr{{O}_{4}}^{2-})•2c({H}^{+})}{c(C{r}_{2}{{O}_{7}}^{2-})•c({H}_{2}O)}$ |
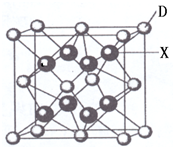 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC 2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC 2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC 2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC 2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).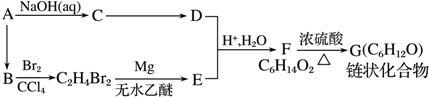
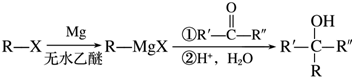 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)