题目内容
4.常温下,下列各组离子一定能在指定溶液中大量共存的是( )| A. | 1.0 mol•L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液:NH4+、Ca2+、Cl-、NO3- | |
| C. | pH=1的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | 由水电离产生c(H+)=10-10mol/L的溶液:NH4+、Ca2+、AlO2-、S2- |
分析 A.酸性条件下NO3-具有强氧化性;
B.$\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液呈酸性;
C.pH=1的溶液呈酸性;
D.由水电离产生c(H+)=10-10mol/L的溶液可能呈酸性或碱性.
解答 解:A.酸性条件下NO3-具有强氧化性,具有还原性的Fe2+不能大量共存,故A错误;
B.$\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液呈酸性,离子之间不发生任何反应,可大量共存,故B正确;
C.pH=1的溶液呈酸性,酸性条件下Ag(NH3)2+不能大量共存,故C错误;
D.由水电离产生c(H+)=10-10mol/L的溶液可能呈酸性或碱性,酸性条件下AlO2-、S2-不能大量共存,碱性条件下NH4+不能大量共存,故D错误.
故选B.
点评 本题考查离子共存的判断,为高考的高频题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.依据反应原理回答下列问题:
Ⅰ.请你利用原电池原理,设计实验,比较铜和铁的金属活动性.
实验用品:铁片、铜片、导线、金属夹、小灯泡、硫酸亚铁溶液、硫酸铜溶液、500mL烧杯.
画出实验装置简图,并标出正负极、电子流动方向.
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是研究温度对H2O2分解速率的影响.
实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图2所示,则A、B、C三点所表示的瞬时反应速率最慢的是C.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图3甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除氯离子的干扰.
②定量分析:用图3乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是收集40mL气体所需的时间.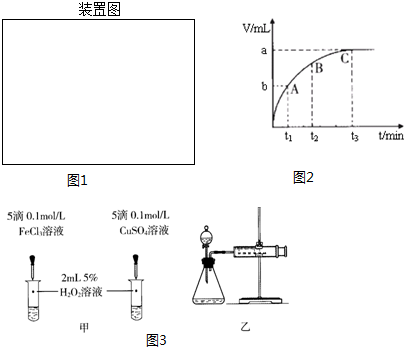
Ⅰ.请你利用原电池原理,设计实验,比较铜和铁的金属活动性.
实验用品:铁片、铜片、导线、金属夹、小灯泡、硫酸亚铁溶液、硫酸铜溶液、500mL烧杯.
画出实验装置简图,并标出正负极、电子流动方向.
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入3mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入3mL 5% H2O2溶液和3mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
(2)实验①的目的是研究温度对H2O2分解速率的影响.
实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图2所示,则A、B、C三点所表示的瞬时反应速率最慢的是C.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图3甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除氯离子的干扰.
②定量分析:用图3乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是收集40mL气体所需的时间.

12.下列各组物质中,最难发生化学反应的是( )
| A. | H2SO4和Ba(OH)2 | B. | CO2和NaOH | C. | CaCO3和HCl | D. | Mg(OH)2和CuSO4 |
19.常温下0.1mol•L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
| A. | 将溶液稀释到原体积的2倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2 mol•L-1盐酸 | D. | 加少量冰醋酸 |
9.关于铜锌原电池的下列叙述正确的是 ( )


| A. | 正极表面出现气泡 | B. | 电池反应:Zn+Cu2+=Zn2++Cu | ||
| C. | 在外电路中,电流从负极流向正极 | D. | 盐桥中K+移向ZnSO4溶液 |
16.一定温度下,100mL6mol•L-1的硫酸与过量锌粉反应,为了减缓反应速率,但又不影响生成氢气的总质量,可向反应中加入适量的( )
| A. | 碳酸钠固体 | B. | 少量锌粉 | C. | 硫酸钾溶液 | D. | 盐酸溶液 |
13.下列装置都可制取HCl气体,其中药品选用错误的是( )
| A. |  | B. |  | C. |  | D. |  |
 .
.