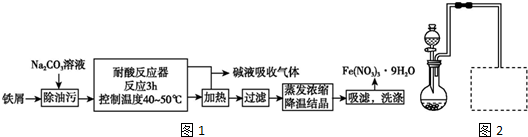
题目内容
3.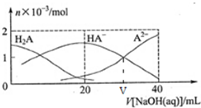 25℃下,向20mL0.1mol/LH2A溶液中滴加0.1mol/LNaOH 溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
25℃下,向20mL0.1mol/LH2A溶液中滴加0.1mol/LNaOH 溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )| A. | H2A 电离方程式 H2A═2H++A2- | |
| B. | V[NaOH(aq)]=20mL 时,溶液显碱性 | |
| C. | 已知25℃时 K2(H2A)=1.0×10-9.1,则V[NaOH(aq)]=VmL 时,pH=9.1 | |
| D. | V[NaOH(aq)]=20mL时时,溶液中存在关系:(HA-)+C(A2-)+C(H2A)=0.1mol/L |
分析 A.图中曲线分析可知溶液中存在酸的分子,说明为弱酸;
B.当V(NaOH)=20时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,电离为主,溶液显酸性;
C.第二步电离HA-?H++A2-,平衡常数Ka2=$\frac{c({H}^{+})c({A}^{2-})}{c(H{A}^{-})}$,则V[NaOH(aq)]=VmL 时c(A2-)=c(HA-),得到溶液中氢离子浓度计算溶液PH;
D.当V(NaOH)=20时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,溶液中存在物料守恒分析.
解答 解:A.图中曲线分析可知溶液中存在酸H2A的分子,说明为弱酸,则H2A在水中的电离方程式是:H2A?H++HA-;HA-?H++A2-,故A错误;
B.当V(NaOH)=20 mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,HA-电离大于水解,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B错误;
C.第二步电离HA-?H++A2-,平衡常数Ka2=$\frac{c({H}^{+})c({A}^{2-})}{c(H{A}^{-})}$,则V[NaOH(aq)]=VmL 时c(A2-)=c(HA-),Ka2=c(H+)=1.0×10-9.1,PH=9.1,故C正确;
D.当V(NaOH)=20时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,溶液中存在物料守恒,(HA-)+C(A2-)+C(H2A)=0.05mol/L,故D错误;
故选C.
点评 本题考查酸碱混合溶液定性判断,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 丙烷与氯气物质的1:2反应 | B. | 丙烯与氯气反应 | ||
| C. | 丙炔与氯气反应 | D. | 丙烯与氯化氢反应 |
| A. | 与金属钠反应放出氢气 | B. | 使溴的四氯化碳溶液褪色 | ||
| C. | 与氢氧化钠溶液反应 | D. | 使高锰酸钾溶液褪色 |
| A. | 节日期间,在开阔的广场燃放烟花爆竹 | |
| B. | 进入煤矿井时,用火把照明 | |
| C. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| D. | 实验时,将水倒入浓硫酸配制稀硫酸 |
| A. | PCl5 | B. | CCl4 | C. | NF3 | D. | N2 |
| A. | 碳酸氢钠与少量硫酸氢钠溶液反应:HCO3-+HSO4-═CO2↑+H2O+SO42- | |
| B. | 硫酸氢钾溶液中滴入氢氧化钡溶液至完全沉淀: Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | NH4Al(SO2)2溶液中加入过量Ba(OH)2溶液: Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
 (A用其中一种结构表示,下同).A在NaOH溶液中加热发生水解(皂化)反应,反应的化学方程式为
(A用其中一种结构表示,下同).A在NaOH溶液中加热发生水解(皂化)反应,反应的化学方程式为 .
.