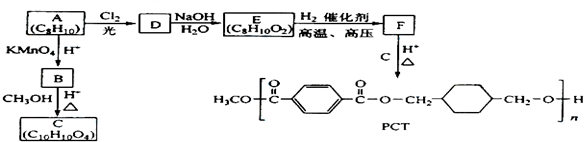
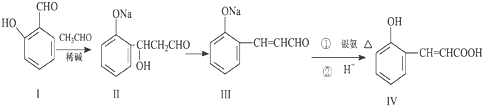
题目内容
t℃时,将2molA和6molB 充入容积固定为2L的密闭容器中发生反应A(g)+2B(g)?2C(g).反应2min时测得C的浓度为0.4mol?L-1,4min末反应达到平衡,B的转化率为60%,试计算:
(1)第2min到第4min内A的平均反应速率.
(2)t℃时该反应的平衡常数.
(3)若从反应开始到建立平衡时放出热量353.88kJ,则该反应的△H=?
(1)第2min到第4min内A的平均反应速率.
(2)t℃时该反应的平衡常数.
(3)若从反应开始到建立平衡时放出热量353.88kJ,则该反应的△H=?
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算,4min末反应达到平衡,B的转化率为60%,
A(g)+2B(g)?2C(g)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.9 1.8 1.8
平衡量(mol/L) 0.1 1.2 1.8
(1)反应速率V=
;
(2)平衡常数=
;
(3)依据反应焓变是指完全反应时的热量变化,结合反应过程中达到平衡时消耗量,放出热量353.88kJ,计算反应焓变.
A(g)+2B(g)?2C(g)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.9 1.8 1.8
平衡量(mol/L) 0.1 1.2 1.8
(1)反应速率V=
| △c |
| △t |
(2)平衡常数=
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
(3)依据反应焓变是指完全反应时的热量变化,结合反应过程中达到平衡时消耗量,放出热量353.88kJ,计算反应焓变.
解答:
解:(1)反应2min时测得C的浓度为0.4mol?L-1,
A(g)+2B(g)?2C(g)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.2 0.4 0.4
2min量(mol/L) 0.8 2.6 0.4
4min平衡量(mol/L) 0.1 1.2 1.8
第2min到第4min内消耗A的浓度=0.8mol/L-0.1mol/L=0.7mol/L,则A的平均反应速率=
=0.35mol/L?min;
答:第2min到第4min内A的平均反应速率为0.35mol/L?min;
(2)依据化学平衡三段式列式计算,4min末反应达到平衡,B的转化率为60%,
A(g)+2B(g)?2C(g)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.9 1.8 1.8
平衡量(mol/L) 0.1 1.2 1.8
平衡常数K=
=22.5;
答:t℃时该反应的平衡常数为22.5;
(3)若从反应开始到建立平衡时放出热量353.88kJ,是消耗A物质的量=0.9mol/L×2L=1.8mol,放出的热量,则1molA完全反应放热196.6KJ,则该反应的△H=-196.6KJ/mol;
答:若从反应开始到建立平衡时放出热量353.88kJ,则该反应的△H=-196.6KJ/L;
A(g)+2B(g)?2C(g)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.2 0.4 0.4
2min量(mol/L) 0.8 2.6 0.4
4min平衡量(mol/L) 0.1 1.2 1.8
第2min到第4min内消耗A的浓度=0.8mol/L-0.1mol/L=0.7mol/L,则A的平均反应速率=
| 0.7mol/L |
| 4min-2min |
答:第2min到第4min内A的平均反应速率为0.35mol/L?min;
(2)依据化学平衡三段式列式计算,4min末反应达到平衡,B的转化率为60%,
A(g)+2B(g)?2C(g)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.9 1.8 1.8
平衡量(mol/L) 0.1 1.2 1.8
平衡常数K=
| 1.82 |
| 0.1×1.22 |
答:t℃时该反应的平衡常数为22.5;
(3)若从反应开始到建立平衡时放出热量353.88kJ,是消耗A物质的量=0.9mol/L×2L=1.8mol,放出的热量,则1molA完全反应放热196.6KJ,则该反应的△H=-196.6KJ/mol;
答:若从反应开始到建立平衡时放出热量353.88kJ,则该反应的△H=-196.6KJ/L;
点评:本题考查了化学平衡常数,化学反应速率概念的计算应用,注意平衡常数是利用平衡你的来计算,题目较简单.

练习册系列答案
相关题目
等体积、等pH的盐酸和醋酸,与NaOH中和时,消耗NaOH的量( )
| A、相同 | B、盐酸多 |
| C、醋酸多 | D、无法比较 |
在相同状况下,将下列四种混合气体:①体积比为3:1的NH3和N2,②体积比为1:1的NO和NO2,③体积比为1:1的NO2和O2,④体积比为4:3的NO和O2.分别置于完全相同的试管里,并倒置与谁操着,充分反应后,液面上升的高度分别为h1 h2 h3 h4,下列关系正确的是( )
| A、h1>h2>h3>h4 |
| B、h4>h3>h1>h2 |
| C、h4>h1>h3>h2 |
| D、h2>h3>h1>h4 |
已知2X+O2→2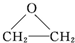 是原子利用率为100%的转化.下列对X的推断中不正确的是( )
是原子利用率为100%的转化.下列对X的推断中不正确的是( )
 是原子利用率为100%的转化.下列对X的推断中不正确的是( )
是原子利用率为100%的转化.下列对X的推断中不正确的是( )| A、可使酸性KMnO4溶液褪色 |
| B、可使溴水褪色 |
| C、一定条件下,可用H2除去乙烷中的X |
| D、与丙烯互为同系物 |