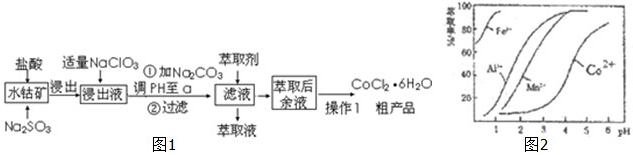
题目内容
(1)在25℃、101kPa的条件下,同质量的CH4和A气体的体积之比是11:4,则A的摩尔质量为 .
(2)在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为 mol/L,SO42-的物质的量浓度为 mol/L.
(3)将5.3gNa2CO3溶于水配成1L溶液,要使Na+浓度变为0.2mol/L,需要加入NaCl固体 g
(4)实验测得CO和O2混合气体的密度是氢气的15.5倍,其中氧气的体积分数为 .
(2)在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为
(3)将5.3gNa2CO3溶于水配成1L溶液,要使Na+浓度变为0.2mol/L,需要加入NaCl固体
(4)实验测得CO和O2混合气体的密度是氢气的15.5倍,其中氧气的体积分数为
考点:物质的量的相关计算
专题:
分析:(1)相同条件下,气体体积之比等于物质的量之比,由于二者质量相等,结合m=nM计算A的摩尔质量;
(2)根据n=
计算Al3+的物质的量,再根据c=
计算c(Al3+),1mol硫酸铝电离得到2molAl3+、3molSO42-),则c[Al2(SO4)3]=
c(Al3+)、c(SO42-)=
c(Al3+);
(3)根据n=
计算碳酸钠物质的量,根据n=cV计算溶液中钠离子物质的量,根据钠离子守恒计算NaCl物质的量,再根据m=nM计算NaCl的质量;
(4)根据相对密度计算混合气体平均相对分子质量,假设氧气体积分数为x,则CO体积分数为(1-x),根据平均相对分子质量列方程计算.
(2)根据n=
| m |
| M |
| n |
| V |
| 1 |
| 2 |
| 3 |
| 2 |
(3)根据n=
| m |
| M |
(4)根据相对密度计算混合气体平均相对分子质量,假设氧气体积分数为x,则CO体积分数为(1-x),根据平均相对分子质量列方程计算.
解答:
解:(1)相同条件下,气体体积之比等于物质的量之比,二者质量相等,设A的摩尔质量为Mg/mol,则:11mol×16g/mol=4mol×Ag/mol,解得A=44,故答案为:44g/mol;
(2)Al3+的物质的量为
=
mol,则c(Al3+)=
=
mol/L,1mol硫酸铝电离得到2molAl3+、3molSO42-),则c[Al2(SO4)3]=
c(Al3+)=
×
mol/L=
mol/L,c(SO42-)=
c(Al3+)=
×
mol/L=
mol/L,故答案为:
;
;
(3)碳酸钠物质的量为
=0.05mol,溶液中钠离子物质的量为1L×0.2mol/L=0.2mol,根据钠离子守恒,需要NaCl物质的量为0.2mol-0.05mol×2=0.1mol,需要NaCl的质量为0.1mol×58.5g/mol=5.85g,故答案为:5.85;
(4)混合气体平均相对分子质量为15.5×2=31,假设氧气体积分数为x,则CO体积分数为(1-x),则:32x+28(1-x)=31,解得x=75%,故答案为:75%.
(2)Al3+的物质的量为
| ag |
| 27g/mol |
| a |
| 27 |
| ||
| VL |
| a |
| 27V |
| 1 |
| 2 |
| 1 |
| 2 |
| a |
| 27V |
| a |
| 54V |
| 3 |
| 2 |
| 3 |
| 2 |
| a |
| 27V |
| a |
| 18V |
| a |
| 54V |
| a |
| 18V |
(3)碳酸钠物质的量为
| 5.3g |
| 106g/mol |
(4)混合气体平均相对分子质量为15.5×2=31,假设氧气体积分数为x,则CO体积分数为(1-x),则:32x+28(1-x)=31,解得x=75%,故答案为:75%.
点评:本题考查物质的量有关计算、混合物计算等,难度中等,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
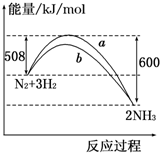

| A、该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol |
| B、a曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的反应热改变 |
| D、在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>Q |
青少年及成人缺乏某种微量元素将导致甲状腺肿大,而且会造成智力损坏,该微量元素是( )
| A、碘 | B、铁 | C、钙 | D、碳 |
菲的结构简式可表示为 ,若菲分子中有1个H原子被Cl原子取代,则所得一氯取代产物有( )
,若菲分子中有1个H原子被Cl原子取代,则所得一氯取代产物有( )
 ,若菲分子中有1个H原子被Cl原子取代,则所得一氯取代产物有( )
,若菲分子中有1个H原子被Cl原子取代,则所得一氯取代产物有( )| A、4种 | B、5种 | C、6种 | D、7种 |
下列关于钠的说法不正确的是( )
| A、金属钠和氧气反应,条件不同,产物不同 |
| B、钠长期置于空气中,表面不能形成致密氧化膜 |
| C、钠与水反应时,钠熔成小球在水面四处游动 |
| D、由于钠比较活泼,所以它能从溶液中置换出金属活动性顺序表中钠后面的金属 |
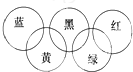 奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )