题目内容
20.在密闭容器中,通入xmolH2(g)和xmolI2(g),改变下列条件,反应速率将如何改变?(填“增大”“减小”“不变”)理由是什么(从活化分子和活化能角度分析)?
(1)升高温度 反应速率增大理由活化分子的百分数增大
(2)加入正催化剂 反应速率增大理由活化分子的百分数增大
(3)扩大容器的体积 反应速率减小理由反应物浓度减小.
分析 在密闭容器中H2和I2发生H2+I2(g)?2HI,对应该反应来说,升高温度、加入催化剂或增大反应物的浓度都可增大反应速率,以此解答.
解答 解:(1)升高温度,活化分子的百分数增大,反应速率增大,故答案为:增大;活化分子的百分数增大;
(2)加入催化剂,降低反应的活化能,活化分子的百分数增大,反应速率增大,故答案为:增大;活化分子的百分数增大;
(3)扩大容器的体积,反应物浓度减小,则反应速率减小,故答案为:减小;反应物浓度减小.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力和基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大,注意把握影响化学反应速率的因素与影响原因的关系.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
10.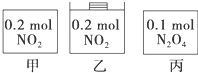 甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )
甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )
 甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )
甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )| A. | 平衡时各容器内n(NO2)的大小顺序为乙>甲>丙 | |
| B. | 平衡时NO2的百分含量:乙>甲=丙 | |
| C. | 平衡时甲中NO2与丙中N2O4的转化率一定相同 | |
| D. | 平衡时混合物的平均相对分子质量:乙>甲=丙 |
8.下列热化学方程式书写和表示正确的是(△H的绝对值均正确)( )
| A. | 2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol(反应热) | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol(燃烧热) | |
| C. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3kJ/mol(中和热) | |
| D. | 2NO2=O2+2NO△H=-116.2kJ/mol(反应热) |
5.在干燥的烧瓶中充满标况下HCl与N2的混合气体,已知其平均相对分子质量是34.8,进行喷泉实验后所得溶液的物质的量浓度为(假设溶液不扩散)( )
| A. | $\frac{1}{22.4}$mol/L | B. | $\frac{1}{36.5}$mol/L | C. | $\frac{4}{5}$×$\frac{1}{22.4}$mol/L | D. | 无法计算 |
12.化学与生产、生活密切相关,下列表述错误的是:( )
| A. | 使用新能源,减少化石燃料的燃烧,可防止酸雨的产生 | |
| B. | 光化学烟雾的形成与汽车尾气中的氮氧化物有关 | |
| C. | 建设三峡大坝使用了大量水泥,水泥是使用量最大的无机非金属材料之一 | |
| D. | “鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
9.化学物质丰畜多彩,其与生产、生活密切相关.下列物质的用途不正确的是( )
| A. | 食醋可用于除去暖水瓶中的水垢 | B. | 纯碱可除去灶具上的油污 | ||
| C. | 酒精可用于杀菌消毒 | D. | 单质硅可用作光缆 |
10.下列说法正确的是( )
| A. | 4mol浓盐酸与足量的二氧化锰反应生成1mol氯气 | |
| B. | 青铜是我国使用最早的合金,它的硬度和熔点都比铜的大 | |
| C. | 二氧化硅导电性能好,可用作光导纤维 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):