题目内容
近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题.
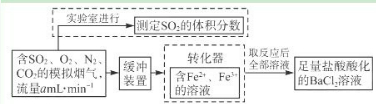
(I)将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液.
(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸.
(III)将盐酸加入NaHSO3溶液中得SO2气体回收.
①上述流程中,可循环利用的物质:______
②写出步骤(III)反应的离子方程式:______
(2)某实验小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号)______.
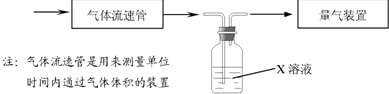
A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2.该方法涉及到的化学反应为:SO2+2CO=2CO2+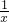 Sx、CO+
Sx、CO+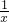 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+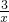 Sx.其中COS的电子式______.
Sx.其中COS的电子式______.
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在硝化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体.请写出加入甲醇后反应的离子方程式______.
解:(1)①电解氯化钠溶液时,需要氯化钠,最终的反应中,亚硫酸氢钠和盐酸反应生成氯化钠,所以能循环利用的物质是氯化钠,故答案为:NaCl;
②盐酸的酸性比亚硫酸强,盐酸与亚硫酸钠反应生产二氧化硫气体,反应的离子方程式为HSO3-+H+═SO2↑+H2O,
故答案为:HSO3-+H+═SO2↑+H2O;
(2)测定模拟烟气中SO2的体积分数,可根据二氧化硫气体的还原性,与具有氧化性的酸性高锰酸钾或碘水反应,通过颜色的变化判断,选项中AB符合,都有颜色,且都具有氧化性,能与二氧化硫反应,故选AB;
(3)COS的结构和二氧化碳相似,根据二氧化碳的电子式知COS的电子式为: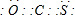 ,故答案为:
,故答案为: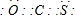 ;
;
(4)酸性条件下,甲醇和硝酸根反应生成氮气、二氧化碳和水,离子方程式为:6NO3-+5CH3OH+6H+═3N2+5CO2+13H2O,
故答案为:6NO3-+5CH3OH+6H+═3N2+5CO2+13H2O.
分析:(1)(I)二氧化硫和氢氧化钠反应生成NaHSO3,(Ⅱ)电解饱和食盐水所得气体氢气和氯气,氢气在氯气中燃烧生成氯化氢,氯化氢溶于水得到盐酸,(III)将盐酸加入NaHSO3溶液中得SO2气体和氯化钠,根据反应过程中最初的反应物中含有该物质,最终的反应中有该物质,这样的物质能循环利用;
(2)测定模拟烟气中SO2的体积分数,可根据二氧化硫气体的还原性,与具有氧化性的酸性高锰酸钾或碘水反应,通过颜色的变化判断;
(3)COS的结构和二氧化碳相似,根据二氧化碳的电子式确定该物质的电子式;
(4)酸性条件下,甲醇和硝酸根反应生成两种两种无毒气体,这两种气体是二氧化碳和氮气,根据反应物和生成物写出离子方程式.
点评:本题考查酸雨的治理原理探究,题目难度中等,注意二氧化硫的性质,以及COS的结构.
②盐酸的酸性比亚硫酸强,盐酸与亚硫酸钠反应生产二氧化硫气体,反应的离子方程式为HSO3-+H+═SO2↑+H2O,
故答案为:HSO3-+H+═SO2↑+H2O;
(2)测定模拟烟气中SO2的体积分数,可根据二氧化硫气体的还原性,与具有氧化性的酸性高锰酸钾或碘水反应,通过颜色的变化判断,选项中AB符合,都有颜色,且都具有氧化性,能与二氧化硫反应,故选AB;
(3)COS的结构和二氧化碳相似,根据二氧化碳的电子式知COS的电子式为:
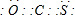 ,故答案为:
,故答案为: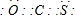 ;
;(4)酸性条件下,甲醇和硝酸根反应生成氮气、二氧化碳和水,离子方程式为:6NO3-+5CH3OH+6H+═3N2+5CO2+13H2O,
故答案为:6NO3-+5CH3OH+6H+═3N2+5CO2+13H2O.
分析:(1)(I)二氧化硫和氢氧化钠反应生成NaHSO3,(Ⅱ)电解饱和食盐水所得气体氢气和氯气,氢气在氯气中燃烧生成氯化氢,氯化氢溶于水得到盐酸,(III)将盐酸加入NaHSO3溶液中得SO2气体和氯化钠,根据反应过程中最初的反应物中含有该物质,最终的反应中有该物质,这样的物质能循环利用;
(2)测定模拟烟气中SO2的体积分数,可根据二氧化硫气体的还原性,与具有氧化性的酸性高锰酸钾或碘水反应,通过颜色的变化判断;
(3)COS的结构和二氧化碳相似,根据二氧化碳的电子式确定该物质的电子式;
(4)酸性条件下,甲醇和硝酸根反应生成两种两种无毒气体,这两种气体是二氧化碳和氮气,根据反应物和生成物写出离子方程式.
点评:本题考查酸雨的治理原理探究,题目难度中等,注意二氧化硫的性质,以及COS的结构.

练习册系列答案
相关题目
