��Ŀ����
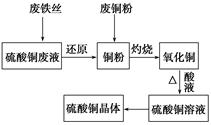
ij��ѧ��ȤС����ֻ������������ͭ�Ĺ�ҵ������ȡ�������Ȼ�����Һ���̷�����(FeSO4��7H2O)�͵������壬��̽����ҵ���ϵ������á���ʵ�鷽�����£�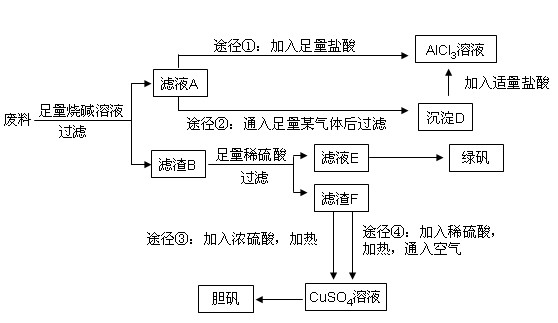
��1��д���Ͻ����ռ���Һ��Ӧ�����ӷ���ʽ�� ��
��2������ҺA��AlCl3��Һ��;���Тٺ͢����֣�;������ͨ���ij���壨��̬ʱ�������˹����꣩��д��������ĵ���ʽ ������Ϊ�Ϻ�����;���� ����ٻ�ڣ��������ǣ� ��
��3����ҺE�������ڿ�����һ��ʱ�����Һ�е������ӳ��� ��
�� �⣬�����ܴ��� �������ӷ��ű�ʾ�����������ӵķ����� ��
�⣬�����ܴ��� �������ӷ��ű�ʾ�����������ӵķ����� ��
��4��������Fͨ������;����ȡ��������;������ȣ�;�������Ծ��е������ŵ��ǣ� �� ��
��5��;���ܷ����ķ�Ӧ�Ļ�ѧ����ʽΪ�� ��
��6��ʵ���Ҵ�CuSO4��Һ��ȡ��������������������Ũ������ȴ�ᾧ�� ����Ȼ���
��1��2Al +2OH�D + 2H2O = 2AlO2�D +3H2�� (2��)
��2�� (1��) �� (1��) ;������ȡ��AlCl3��Һ�л���NaCl����(1��)
(1��) �� (1��) ;������ȡ��AlCl3��Һ�л���NaCl����(1��)
��3��Fe3�� (1��) ȡ�����μ�KSCN������Ѫ��ɫ������Fe3�� ��(1��)
��4���ɱ��� (1�֣��������֣���ͬ) ���������ж����� (1��)
��5��2Cu +2H2SO4 +O2�� 2CuSO4 +2H2O (2��)
��6������ϴ�� (1��)
�������������
��1����������ֻͭ�������ռ���Һ��Ӧ��
��2����NaAlO2��Ӧ����Al(OH)3����̬ʱ�������˹����꣬������CO2 ��NaAlO2 +4HCl=AlCl3+NaCl+2H2O ����AlCl3��Һ�л���NaCl���ʡ�
��3��Fe2��������������Fe3����Fe3����KSCN��Ӧ����Ѫ��ɫ��Fe2�����ܡ�
��4��;����Cu+2H2SO4= CuSO4+ SO2��+2H2O
;���� 2Cu +2H2SO4 +O2 = 2CuSO4 +2H2O;������ϡH2SO4�ɱ��ͣ��������ж�����
���㣺�����Ի�ѧʵ��Ϊ����������Ԫ�ؼ��仯�����ʵ���֪ʶ��

�Ȼ�ͭ��һ�ֹ㷺�����������ϡ���ľ�ķ������Ļ�����Ʒ��ij�о���ѧϰС���ô�ͭ��������Fe�������������Ʊ��Ȼ�ͭ���塣
��1������A��ϡ�����ܽ������ˮ�ܽ��ԭ����________��
��2�����Լ�X���ڵ���pH�Գ�ȥ���ʣ�X��ѡ�������Լ��е�____������ţ���
| A��NaOH | B��NH3.H2O | C��CuO | D��Cu(OH)2E. CuSO4 |
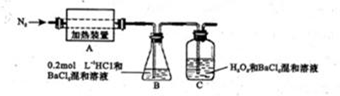
��4��ʵ���Ҳ�������ͼ��ʾװ�ã���ʹ��ͭ��Cl2��Ӧת��Ϊ����A�����ּ��������ͼг�װ������ȥ����
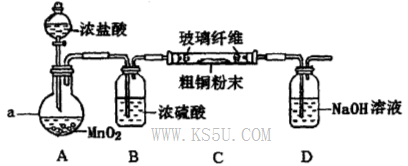
�ٸ�װ��������a��������____�����з�����Ӧ�����ӷ���ʽ��____________��
����ͬѧ��ΪӦ��Ũ����ϴ��ƿǰ��������HCI��װ�ã�����Ϊ�Ƿ��Ҫ��____________����ǡ�����
�۸�װ�ô���һ���İ�ȫ�����������ð�ȫ�����Ĵ�ʩ��_______________________��
ZnO���п����ԣ�Ҳ����Ҫ����̥���Ӽ�����ҵ���ɴ�ZnO(��FeO��CuO)�Ʊ�����ZnO�������£� 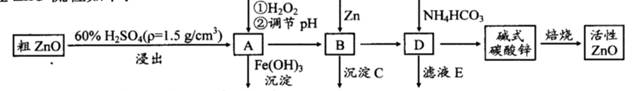
��֪����Һ��Fe2+��Fe3+��Cu2+��Zn2+�γ����������pH���±���
| ���� | ��ʼ������pH | ��ȫ������pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9 |
(1)ʵ��������98��H2SO4������100 mL60��ϡ��������ʹ�õIJ��������У��ձ�����Ͳ�� �� �� ��
(2)д����A�м�H2O2�����ӷ���ʽ�� ��
(3)��A�п��Լ��� (д��ѧʽ)������ҺpH��Χ�� ֮�䣻����CΪ ��
(4)��ʽ̼��п[Zn3(OH)4CO3��H2O]�����Ʊ�����ZnO�Ļ�ѧ����ʽΪ ��