题目内容
下表是某地市场上销售的一种“加碘食盐”包装袋上的部分文字说明.请根据该表回答下列问题:
(1)在食盐中加碘酸钾而不加碘化钾,最可能的原因是 .
(2)由食用方法和贮藏指南,可推测碘酸钾的化学性质之一是 .
(3)碘酸钾(KIO3)能发生如下反应:5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O.此反应中氧化剂和还原剂的物质的量之比是 .
(1)在食盐中加碘酸钾而不加碘化钾,最可能的原因是
(2)由食用方法和贮藏指南,可推测碘酸钾的化学性质之一是
| 配 料 | 氯化钠、碘酸钾 |
| 含碘量 保质期 食用方法 贮存指南 | (20mg-40mg)/kg 18个月 勿长时间炖妙 避热、避光、密闭、防潮 |
考点:氯、溴、碘及其化合物的综合应用,氧化还原反应
专题:
分析:(1)KI不稳定,易被氧化而变质;
(2)由题给信息可知含碘食盐勿长时间炖妙,且避热、避光,说明碘酸钾不稳定;
(3)该反应中I元素化合价由-1价、+5价变为0价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂.
(2)由题给信息可知含碘食盐勿长时间炖妙,且避热、避光,说明碘酸钾不稳定;
(3)该反应中I元素化合价由-1价、+5价变为0价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂.
解答:
解:(1)食盐中的碘以稳定形式存在,而KI不稳定,易被氧化而变质,导致口感差,故答案为:KI以氧化变质且口感差;
(2)含碘食盐勿长时间炖妙,且避热、避光,说明碘酸钾不稳定,受热易分解,故答案为:碘酸钾不稳定,受热易分解;
(3)5KI+KIO3+3H2SO4═3I2+3K2SO4+3H2O中,KI中I元素的化合价由-1价升高0,KIO3中I元素的化合价由+5价降低为0,
含元素化合价降低的物质为氧化剂,则氧化剂为KIO3,
含元素化合价升高的物质为还原剂,则还原剂为KI,
氧化剂和还原剂的物质的量之比是1:5,
故答案为:1:5.
(2)含碘食盐勿长时间炖妙,且避热、避光,说明碘酸钾不稳定,受热易分解,故答案为:碘酸钾不稳定,受热易分解;
(3)5KI+KIO3+3H2SO4═3I2+3K2SO4+3H2O中,KI中I元素的化合价由-1价升高0,KIO3中I元素的化合价由+5价降低为0,
含元素化合价降低的物质为氧化剂,则氧化剂为KIO3,
含元素化合价升高的物质为还原剂,则还原剂为KI,
氧化剂和还原剂的物质的量之比是1:5,
故答案为:1:5.
点评:本题以含碘食盐为载体综合考查元素化合物以及氧化还原反应知识,侧重考查基本概念和计算,明确元素化合价变化即可解答,熟练掌握常见元素化合价,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、化学反应一步完成与分几步完成,反应热是不同数值 |
| B、盖斯定律解决的是化学反应过程问题 |
| C、盖斯定律在科研中的重要作用在于可以解决反应很慢或不直接发生的反应的反应热问题 |
| D、无法用盖斯定律计算反应热 |
下列有关氟利昂的说法,不正确的是( )
| A、氟利昂是一类含氟和氯的卤代烃 |
| B、氟利昂化学性质稳定,有毒 |
| C、氟利昂大多无色、无味、无毒 |
| D、在平流层中,氟利昂在紫外线照射下,分解产生的氯原子可引发损耗臭氧层的循环反应 |
元素溴是1826年一位法国科学家发现的,他在研究海水制盐时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,进一步提取,得到一种红棕色、有刺鼻臭味的液体,这种液体就是溴单质.只用溴水就可将下列各种溶液鉴别出来的是( )
| A、水、汽油、酒精 |
| B、AgNO3、NaOH、KI |
| C、NaCl、NaBr、NaI |
| D、汽油、酒精、NaCl |
下列叙述正确的是( )
| A、鉴别两种无色溶液Na2CO3与NaHCO3可以用石灰水 |
| B、Mg和Cu的冶炼方法一定要用相同方法:热还原法 |
| C、SO2与CO2对环境污染的原理:均形成酸雨 |
| D、Na2SiO3与Na2O?SiO2是同种物质:都是硅酸盐 |
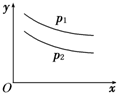 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数;据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数;据此可判断( )| A、上述反应是放热反应 |
| B、上述反应是吸热反应 |
| C、a>b |
| D、无法确定a、b的大小 |