题目内容
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于_________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加时先加________ 后加________,原因是_____________________________________________________________。
(3)目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂, 则水中的Ca2+、Mg2+与交换树脂的________起离子交换作用。若使用NaR作为阳离子交换树脂,失效后可放入5%~8%_____________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
①阳离子交换膜是指______________(填A或B)。
②写出通电后阳极区的电极反应式:_____________________________.
阴极区的现象是:_______________________________________________.
(1)永久(2分)
(2)石灰 纯碱 过量的钙离子可用纯碱沉淀下来(每空2分)
(3)H+ NaCl (每空1分)
(4)①B (1分) ②2Cl--2e-= Cl2↑ 有气体放出,
解析试题分析:(1)永久性硬水是指硫酸镁、硫酸钙等盐类加热煮沸后不能不能除去的硬度,而含碳酸氢镁、碳酸氢钙的硬水可通过加热煮沸后沉淀除去,称为暂时性硬水,本题中的硬水中含硫酸根离子和氯离子,不含碳酸氢根离子,所以是永久性硬水
(2)石灰只与镁离子反应不和钙离子反应,而纯碱和二者都反应,所以先加石灰,后加纯碱,原因是过量的钙离子可用纯碱沉淀下来
(3)阳离子交换树脂与其同号离子进行交换,所以Ca2+、Mg2+与交换树脂的H+交换, 若使用NaR作为阳离子交换树脂,则Ca2+、Mg2+与交换树脂的Na+交换,失效后,放在氯化钠的溶液里即可
(4)①通电后钙镁离子应移向电源负极,所以B为阳离子交换膜
②阳极区是阴离子放电,按照离子的放电顺序是氯离子放电,电极反应方程式为:2Cl--2e-= Cl2↑;阴极区是氢离子放电,所以阴极区有气体放出,同时由于氢离子放电导致阴极区氢氧根离子浓度增大,定向移动来的钙镁离子与氢氧根离子结合形成沉淀
考点:考查硬水中钙镁离子的除去方法,电解中离子放电顺序、离子的定向移动

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案某化学小组用下图装置电解CuCl2溶液制少量漂白液: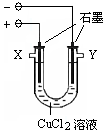

(1)其阳极的反应式是: ;导气管W端应与出气口 连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。
查阅资料显示:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2( OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
化学小组分析提出:①红色物质可能有 、或Cu2O、或二者都有;②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:
取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入下图所示装置b中,

进行实验。实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g 。
①碳棒上的红色物质是 ,无水硫酸铜的作用是 ;
②d中反应的离子方程式是 ;
③装置b中发生反应的化学方程式是 。
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为 。
⑤阴极上产生白色物质的物质的量是 ;若装置b冷却时不继续通H2,则计算所得Cu+的产率会 (偏大、偏小、不变)。
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg·L-1 | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。

①阴极的电极反应式为__________________。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式______________________________________。
③淡水的出口为a、b、c中的________出口。
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示:

该电池电解质为传导Li+的固体材料。放电时该电极是电池的________极(填“正”或“负”),电极反应式为______________________。




