题目内容
16.下列关于各图象的解释或得出结论正确的是( )
| A. | 图1表示0.10mol•L-1NaOH溶液滴定20.00mL0.10mol•L-1醋酸溶液的滴定曲线 | |
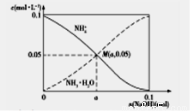
| B. | 图2表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 根据图3所示可知:石墨比金刚石稳定 | |
| D. | 图4表示反应:2SO2+O2?2SO3,t1时刻只减小的SO3的浓度 |
分析 A、醋酸为弱酸,0.1000mol/L的醋酸溶液pH应大于1;
B、乙酸是弱电解质,随通入氨气发生反应生成醋酸铵是盐完全电离,导电性增强;
C、物质能量越高越活泼,由图象可知金刚石能量比石墨能量高;
D、t1时刻只减小的SO3的浓度,此时正反应速率在原平衡点,随反应进行减小.
解答 解:A、由图象可知曲线起始点pH=1,醋酸为弱酸,0.1000mol/L的醋酸溶液pH应大于1,故A错误;
B、乙酸是弱电解质,随通入氨气发生反应生成醋酸铵,CH3COOH+NH3=CH3COONH4,CH3COONH4是盐,水溶液中完全电离,溶液导电性应先增强,图象中导电性减弱,故B错误;
C、物质能量越高越活泼,图象中金刚石能量比石墨能量高,石墨转化为金刚石是吸热反应,所以石墨比金刚石稳定,故C正确;
D、t1时刻只减小的SO3的浓度,此时逆反应速率突然减小,而此时正反应速率应在原平衡点,然后随反应进行减小,故D错误;
故选C.
点评 本题考查了化学图象的分析判断,主要是弱电解质电离平衡,溶液导电性强弱判断,化学平衡影响因素分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如图,则下列说法中正确的是( )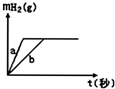

| A. | 曲线a为K,b为Na | B. | 投入的Na的质量大于K的质量 | ||
| C. | 投入的Na、K一定等质量 | D. | 稀盐酸的量一定是不足量的 |
1.298.15K时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
3.某非金属元素X的最高化合价为+m,其最高价氧化物的水化物的分子中有b个氧原子,则该元素氢化物的分子式为( )
| A. | Hm+2bX | B. | Hm-2bX | C. | Hm-8X | D. | H8-mX |
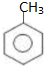
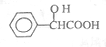 ,工业上扁桃酸可以由烃A经过以下步骤合成得到:
,工业上扁桃酸可以由烃A经过以下步骤合成得到: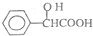
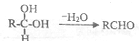
 ;扁桃酸中含氧官能团名称羟基、羧基.
;扁桃酸中含氧官能团名称羟基、羧基. .
. )在浓硫酸作用下反应生成,请写出反应的化学方程式
)在浓硫酸作用下反应生成,请写出反应的化学方程式
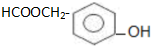 .
.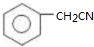 )为原料合成扁桃酸的同分异构体-对羟基苯乙酸(
)为原料合成扁桃酸的同分异构体-对羟基苯乙酸(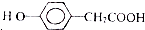 )的合理路线.
)的合理路线. OH-+H3PO4
OH-+H3PO4
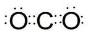



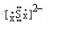 .
.